У клітинах людини і тварин глікоген є запасним енергетичним матеріалом. Особливо багато його в клітинах печінки і м'язів. В організмі дорослої людини може міститися до 450 м глікогену.
Глікоген синтезується в період травлення (через 1-2 години після прийому вуглеводів їжі). Синтез глікогену як будь-який процес синтезу вимагає витрат енергії. Глюкоза, яка надходить в клітку фосфорилируется, в результаті утворюється глюкозо-6-фосфат. Каталізує процес фермент - гексокіназа. Далі глюкозо-6-фосфат під дією ферменту - фосфоглюкомутази перетворюється в глюкозо-1-фосфат, який потім за участю ферменту УДФ-глюкозопірофосфорілази перетворюється в УДФ-глюкозу. Ця реакція вимагає участі нового макроергічної з'єднання - УТФ (реакція є незворотною). Так як глікоген в клітці ніколи не повинен розщеплюється повністю, синтез глікогену здійснюється шляхом подовження вже наявної молекули глікогену, званої «затравки», що складається з 4-х і більше залишків глюкози, так як більш короткі фрагменти «не пізнаються» ферментом і процес синтезу глікогену припиняється, що врешті-решт призводить організм до загибелі.
Субстратом, що використовується для подовження ланцюгів глікогену, є УДФ-глюкоза. Роль «затравки» можуть виконувати також глікозідази з різним ступенем полімеризації, або білкові попередники, до яких попередньо приєднані залишки глюкози. Каталізує процес подовження ланцюгів глікогену головний регуляторний фермент синтезу глікогену - глікогенсинтетазу.
Глікогенсинтетазу подовжує нередуцирующего гілка глікогену з утворенням # 945; -1,4-глікозидних зв'язків доти, поки в цьому ланцюзі не буде до ділянки розгалуження не менше 11 глюкозних залишків. Після цього вступає в дію так званий «ветвящегося» фермент. Він каталізує перенесення кінцевого олігосахарідним фрагмента, що складається з 6-7 залишків глюкози з нередуцирующего кінця ланцюга, що налічує не менше 11 залишків глюкози на внутрішній залишок глюкози цієї або іншої ланцюга з утворенням в цьому місці 1,6-гликозидной зв'язку і, отже, появою нового розгалуження. Після цього глікогенсинтетазу може додавати до цієї бічного ланцюга нові залишки глюкози.
Головним або основним шляхом розпаду глікогену є фосфороліз глікогену або глікогеноліз. Розпад глікогену відбувається у відповідь на підвищення потреби організму в глюкозі.
Спочатку від глікогену під дією активної (фосфорильованій) глікогенфосфорилази отщепляется глюкозо-1-фосфат. Процес йде з використанням неорганічного фосфату. Так само як і синтез, розщеплення глікогену починається з нередуцирующего гілок полісахариду. Глікогенфосфорилази знову і знову атакує нередуцирующего гілки глікогену до тих пір, поки не дійде до точки, віддаленої на чотири глюкозних одиниці від # 945; -1,6-гликозидной зв'язку. Тут дія ферменту припиняється. Після цього на глікоген в даній ділянці починає діяти так званий «деветвящій» фермент, що володіє двома різними ферментативними активностями - трансферазной і глюкозідазной. За допомогою цього ферменту спочатку три залишилися до точки розгалуження глюкозних залишку переносяться на будь-яку нередуцирующего гілка, подовжуючи її. Що залишився в точці розгалуження глюкозний залишок далі гидролитически отщепляется з утворенням вільної глюкози. Продукт дії глікогенфосфорилази - глюкозо-1-фосфат під дією фосфоглюкомутази перетворюється в глюкозо-6-фосфат. Далі глюкозо-6-фосфат включається в процеси катаболізму або інші метаболічні шляхи. У клітинах печінки він може гидролизоваться під дією ферменту глюкозо-6-фосфатази до вільної глюкози, яка далі може надходити в кров. У скелетних м'язах цей фермент відсутній, тому глюкозо-6-фосфат використовується м'язами для отримання енергії в процесі катаболізму глюкози - гликолизе.
Регуляція синтезу і розпаду глікогену здійснюється реципрокно. Реципрокная регуляція означає, що один і той же одномоментне вплив на регуляторні ферменти глікогенсінтази і глікогенфосфорілазу (фосфорилювання або дефосфорілірованіе) викликає активацію одного з цих ферментів з синхронної інактивацією іншого. Контролюють інтенсивність процесів фосфорилювання-дефосфорилирования в клітинах - гормони (інсулін, глюкагон, адреналін). Так, наприклад, одномоментне фосфорилирование глікогенсинтетазу і глікогенфосфорилази призводить до активації глікогенфосфорилази і інактивації глікогенсинтетазу, що призводить до запуску процесу розпаду глікогену і зупинці синтезу останнього.
Гормон підшлункової залози - інсулін підсилює процеси дефосфорилирования в клітинах, отже, зупиняє процеси розпаду глікогену і підсилює його синтез. У клітинах печінки інсулін індукує синтез глюкокинази - ферменту, що каталізує процес утворення глюкозо-6-фосфату тоді, коли концентрація глюкози в крові велика. Тому синтез глікогену в печінці активується через деякий час після прийому їжі, що містить вуглеводи.
Антагоністи інсуліну по біологічних ефектів глюкагон і адреналін по каскадним механізмам підсилюють процеси фосфорилювання в клітинах, тим самим посилюють розпад глікогену і гальмують його біосинтез.
Оскільки на клітинах печінки крім # 946; 2-адренорецепторів є ще й # 945; 1 -адренорецептори, то адреналін має здатність посилювати розпад глікогену з використанням для цього іонів кальцію (активує Са +2 -зв'язуючим білки і, в кінцевому підсумку, підсилює процеси фосфорилювання).
У поперечно-смугастих м'язах фермент киназа фосфорілази має особливості, цей фермент містить центр зв'язування іонів кальцію.
При підвищенні концентрації іонів кальцію в саркоплазме в момент м'язового скорочення іони кальцію зв'язуються з кінази фосфорілази і активують її. В результаті при м'язовій роботі прискорюється розпад глікогену до глюкозо-6-фосфату, а останній використовується для отримання енергії в процесі гліколізу. Енергія ж АТФ використовується для здійснення роботи м'язами.
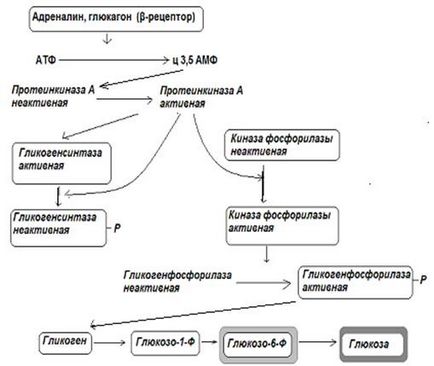
Мал. 12-1. Регуляція синтезу і розпаду глікогену в печінці глюкагоном і адреналіном.
(Р-радикал фосфорної кислоти)
Глікогенози - спадкові захворювання, обумовлені дефектом ферментів, які беруть участь у метаболізмі глікогену.
Хвороба Гірке (тип I) - причина - спадковий дефект глюкозо-6-фосфатази. Хвороба Гірке проявляється гіпоглікемією, підвищенням рівня тригліцеридів в крові, гіперурикемією (підвищенням вмісту сечової кислоти в крові). Можливий ацидоз.
Хвороба Помпа - низька активність або відсутність лізосомальних # 945; -1,4- і # 945; -1,6-гликозидаз. В результаті в лізосомах починає накопичуватися глікоген.
Хвороба Форбса або Корі (III тип) вельми респространена. Становить ¼ всіх випадків печінкових гликогенозов. Накопичується глікоген аномальний, так як дефектний «деветвящій» фермент. Недолік глюкози в крові проявляється швидко. На відміну від глікогенозу I типу лактоацидоз і гіперурикемія не відзначається.
Хвороба Андерсен (IV тип) - зустрічається рідко. При цьому захворюванні низька або зовсім відсутня активність «ветвящегося» ферменту. Хвороба розвивається швидко і практично не піддається лікуванню.
Хвороба Мак Ардля (V тип) - проявляється відсутністю м'язової глікогенфосфорилази. Хворі дуже погано переносять м'язові навантаження.
Хвороба Херсі (VI тип) - проявляється симптомами, зумовленими ураженням печінки. Даний глікогеноз - наслідок дефекту глікогенфосфорилази. В гепатоцитах накопичується глікоген нормального будови.
Хвороба Тарді (VII тип) обумовлена дефектом ферменту фосфофруктокинази в еритроцитах і поперечносмугастих м'язах. Хворі можуть виконувати тільки помірні фізичні навантаження.
Рідко зустрічаються також глікогенози розвиваються внаслідок дефектів ферментів: протеїнкінази А, кінази фосфорілази, фосфогліцеролмутази і М субодиниці лактатдегідрогенази.
Гліколіз - шлях катаболізму глюкози в такому значенні:
I - шлях, що дає енергію клітинам. Для клітин, які працюють в анаеробних умовах або за відсутності мітохондрій це єдиний спосіб отримання енергії у вигляді АТФ.
II - деякі метаболіти гліколізу можуть бути використані для біосинтезу замінних амінокислот і ліпідів (ПВК, дігідроксіацетонфосфат).
У гликолизе можна виділити 2 етапи:
1. Підготовчий етап, в ході якого глюкоза фосфорилюється і розщеплюється на дві молекули фосфотріоз. Ця серія реакцій протікає з витратою двох молекул АТФ.
2. Етап, пов'язаний з синтезом АТФ. В результаті цієї серії реакцій фосфотріози перетворюються в піруват. Енергія, що звільняється на цьому етапі, використовується для синтезу АТФ.
Перша стадія гліколізу починається з реакції фосфорилювання глюкози за участю АТФ, іонів магнію і ферменту гексокінази. У клітинах печінки присутній ще один різновид гексокінази, що отримала назву глюкокинази. Глюкокіназа, на відміну від гексокінази, специфічна тільки щодо Д-глюкози, глюкозо-6-фосфат не є для неї інгібітором, володіє більш високим значенням Кm, що забезпечує підвищення концентрації глюкози в клітинах печінки в фосфорильованій формі, відповідно її рівню в портальної крові .
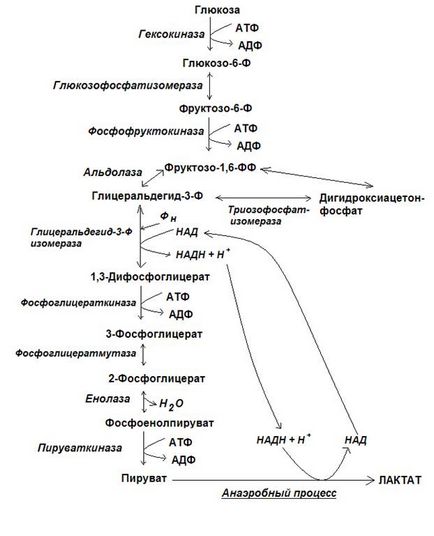
Друга реакція - реакція ізомеризації: глюкозо-6-фосфат перетворюється на фруктозу-6-фосфат під дією ферменту глюкозофосфатізомерази. Реакція оборотна.
Третя реакція - необоротна реакція - реакція другого фосфорилювання йде з витратою АТФ і каталізує цей процес головний регуляторний фермент гліколізу - фосфофруктокінази -1 (ФФК-1). Цей фермент має на поверхні від 7 до 12 центрів зв'язування. Активують ФФК-1 високі концентрації АДФ і, особливо, АМФ, а інгібують: високі концентрації АТФ, цитрату, вільних жирних кислот.
Четверта реакція - реакція розщеплення фруктозо-1,6-дифосфата, здійснюється під дією ферменту альдолази. Реакція оборотна. В ході цієї реакції утворюється два тріозофосфата - глицеральдегид-3-фосфат і дігідроксіацетонфосфат.
П'ята реакція - реакція оборотної ізомеризації відбувається під дією ферменту тріозофосфатізомерази. Реакція зрушена в бік освіти глицеральдегид-3-фосфату, так як останній безперервно і легко втягується в наступні перетворення. Таким чином, можна умовно вважати, що перша стадія гліколізу завершується утворенням з однієї молекули глюкози двох молекул глицеральдегид-3-фосфату.
На другому етапі гліколізу з 2 молекул глицеральдегид-3-фосфату утворюються: 2 молекули ПВК, 2 молекули НАДН + Н + і 4 АТФ.
Сьома реакція - реакція субстратного фосфорилювання відбувається за участю ферменту - фосфогліцераткинази - 1,3-дифосфоглицерата взаємодії з АДФ і утворюється АТФ, а також 3-фосфогліцерат.
Восьма реакція - реакція внутрішньомолекулярного переміщення здійснюється за допомогою ферменту фосфогліцератмутази. В ході цієї реакції залишок фосфорної кислоти переміщається з 3 положення в друге і утворюється 2-фосфогліцерат.
Дев'ята реакція - реакція дегідратації. В результаті цієї реакції утворюється з 2-фосфогліцерата макроенергетичних з'єднання - фосфоенолпіруват (ФЕП). Каталізує реакцію фермент - енолаза.
Десята реакція - реакція другого субстратного фосфорилювання. Реакція необоротна. Каталізує процес фермент - піруваткіназа. Доля відновленого НАД і ПВК, що утворюються в ході гліколізу залежить від того, в якому режимі працює клітина - в аеробному або анаеробному. В анаеробних умовах ПВК відновлюється до молочної кислоти, використовуючи утворився в ході гліколізу НАДН + Н +. НАД після цього повертається в процес і, таким чином, гліколіз не переривається (гліколітична оксідоредукція).
В аеробних умовах отримана в ході гліколізу піровиноградна кислота далі в мітохондріях в загальних шляхах катаболізму розпадається до СО2 і Н2 О, даючи енергію (АТФ).
НАДН + Н +. утворюється при окисленні глицеральдегид-3-фосфату в процесі аеробного гліколізу піддається окисленню шляхом перенесення атомів водню в мітохондріальну дихальну ланцюг. Однак цитозольний НАДН + Н + не здатний передавати водень на дихальний ланцюг, тому що мітохондріальна ланцюг для нього непроникна. Перенесення водню через мембрану відбувається за допомогою спеціальних систем, званих човниковими. У цих системах водень транспортується через мембрану за участю пар субстратів, пов'язаних відповідними дегідрогеназ. Відомі дві човникові системи.
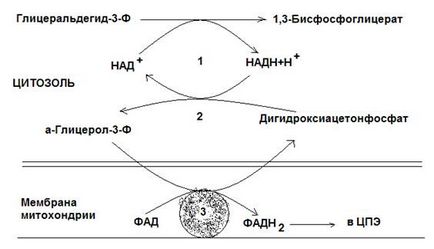
Мал. 12-3. Гліцерофосфатного човникова система.
2 - гліцерин-3-фосфатдегідрогенази (цитозольний фермент, названий по зворотної реакції);
3 - гліцерин-3-фосфатдегідрогенази (мітохондріальний фермент).
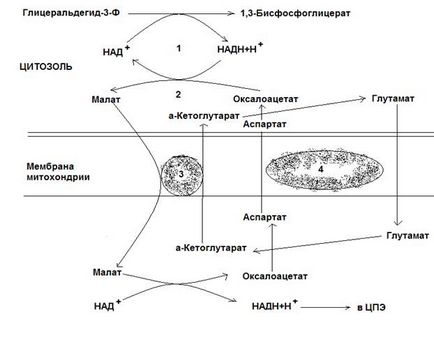
Ріс.12-4. Малат-аспартатного човникова система.
У першій з цих систем водень від НАДН в цитоплазмі передається на дігідроксіацетонфосфат ферментом гліцерин-3-фосфатдегідрогенази (НАД-залежний фермент, названий по зворотної реакції). Утворений в ході цієї реакції гліцерин-3-фосфат, окислюється далі ферментом внутрішньої мембрани мітохондрій - гліцерин-3-фосфатдегідрогенази, ФАД-залежним ферментом). Потім протони й електрони з ФАДН2 переходять на убіхінон і далі по ланцюгу перенесення електронів (ЦПЕ).
Гліцеролфосфатная човникова система працює в клітинах білих м'язів і гепатоцитів.
Друга човникова система, в якій беруть участь малат, цитозольні і мітохондріальна малатдегідрогенази, є більш універсальною. У цитоплазмі НАДН відновлює оксалоацетат в малат, який за участю переносника проходить в мітохондрії, де окислюється в оксалоацетат НАД-залежної малатдегідрогеназа. Відновлений в ході цієї реакції НАД віддає водень в мітохондріальну ЦПЕ. Однак утворений з малата оксалоацетат вийти самостійно з мітохондрій в цитозоль не може, так як мембрана мітохондрій для нього непроникна. Тому оксалоацетат перетворюється в аспартат, який і транспортується в цитозоль, де знову перетворюється в оксалоацетат. Перетворення оксалоацетата в аспартат і назад пов'язані з приєднанням та отщеплением аміногрупи (реакції трансамінування). Ця човникова система називається малат-аспартатного. Результат її роботи - регенерація цитоплазматического НАД з НАДН.
Човникові системи відрізняються за кількістю синтезованого АТФ. У першій системі співвідношення Р / О дорівнює 2, так як водень вводиться в ЦПЕ на рівні КоQ. Друга система енергетично більш ефективна, так як передає водень в ЦПЕ через мітохондріальний НАД і співвідношення Р / О близько до 3.
При анаеробному окисленні глюкози вихід АТФ становить - дві молекули.
При аеробному окисленні глюкози вихід АТФ становить 38 АТФ (малат-аспартатного механізм) або 36 АТФ (# 945; -гліцерол-3-фосфатний механізм).
Регуляція гліколізу здійснюється шляхом зміни активності ряду регуляторних ферментів: фосфофруктокинази -1 (ФФК-1), піруваткінази, гексокінази.
Активність ФФК-1 збільшують: підвищення концентрації АМФ і АДФ, фруктозо-2,6-дифосфата, а знижують - підвищення концентрації АТФ, цитрату, вільних жирних кислот, НАДН.
Активність гексокінази зменшує підвищення концентрації глюкозо-6-фосфату (спостерігається при зниженні активності ФФК-1).
Активність піруваткінази підвищує висока концентрація АДФ, АМФ; знижують активність ферменту - високі концентрації АТФ, НАДН.
Гліколіз може також піддаватися повільної регуляції шляхом зміни концентрації ферментів, що здійснюється за допомогою гормонів: так інсулін - стабілізує біосинтез глюкокинази, ФФК-1 і піруваткінази.