Одним з унікальних властивостей живих організмів є дивовижна їх здатність до збереження збалансованості катаболічних (біодегра-датівная) і анаболічних (биосинтетических) процесів. При цьому в клітинах одночасно відбуваються процеси синтезу, розпаду і взаємоперетворення сотень і тисяч різноманітних речовин. які в свою чергу регулюються безліччю механізмів, що забезпечують постійність внутрішнього середовища організму. Деякі з цих регуляторних механізмів, серед яких важлива роль належить механізмам регуляції синтезу і каталітичної активності ферментів. будуть розглянуті далі.
Вплив закону дії мас. У катализируемой ферментом оборотної хімічної реакції. наприклад А + В <=> З + D, концентрація компонентів реакції і відповідно напрямок реакції будуть регулюватися впливом закону дії мас. Воно, зокрема, може бути показано в оборотної реакції трансамінування. катализируемой ферментом Аланінамінотрансфераза:
аланін + # 945; -Кетоглутарат <=> Піруват + Глутамат.
Цей тип регуляції грає, очевидно, лише обмежену роль, оскільки в реальних умовах реакція зазвичай протікає в одному напрямку, так як утворилися продукти можуть виявитися субстратами для дії інших ферментів і виводитися зі сфери реакції. У цих випадках встановлюється швидше стійке (стаціонарне) стан, ніж справжнє рівновагу.
Зміна кількості ферменту. На бактеріях добре вивчений феномен індукованого (індукує) синтезу ферментів при вирощуванні їх на середовищі, де єдиним джерелом вуглецю та енергії служить той чи інший вуглевод. наприклад глюкоза. Заміна в середовищі глюкози на лактозу (індуктор) призводить до индуцированному або адаптивному (після невеликого періоду лаг-фази) синтезу ферменту галактозидази (програмованого лактозна геном. См. Главу 13), що розщеплює лактозу на глюкозу і галактозу.
У клітинах прокаріотів і еукаріот є ферменти. концентрація яких не вимагає додавання індуктора; це так звані конститутивні ферменти. Кількість ферменту в клітині залежить від наявності продукту реакції. катализируемой даними ферментом. причому продукт реакції викликає пригнічення синтезу ферменту в результаті репресії (див. далі).
У тварин тканинах швидкий синтез ферментів спостерігається рідше. Механізм його (индуцирующий синтез) вивчений тільки для невеликого числа ферментів. тірозінтрансамінази, серін- і треоніндегідратази, тріптофанпірролази і ін. - у відповідь на введення гормонів або прийом білкової їжі. Однак при надходженні в організм деяких отрут, канцерогенних речовин. алкалоїдів. інсектицидів через кілька днів спостерігається різке підвищення активності (відповідно кількості) ферментів-гідроксилази (монооксигеназ) ендоплазматичноїмережі клітин печінки. окислюють чужорідні речовини в нетоксичні для організму продукти. Цілком допустимо припустити, що в цих випадках має місце синтез ферментів шляхом індукції (тобто de novo). Описані випадки, коли під дією подібних гідроксилази чужорідні речовини перетворюються в організмі в більш токсичні сполуки. Це явище, зворотне детоксикації, отримало назву летального синтезу.
Проферменти. Протеолітичні ферменти травного тракту, а також підшлункової залози синтезуються в неактивній формі - у вигляді проферментов (зімогенов). Регуляція в цих випадках зводиться до перетворення проферментов в активні ферменти під впливом специфічних агентів або інших ферментів - протеїназ. Так, трипсин в підшлунковій залозі синтезується в формі неактивного трипсиногена. Поступово в кишечник, він перетворюється в активний трипсин в результаті аутокаталіз або під дією інших протеїназ (механізм активації детально розглядається в розділі 12). Перетворення неактивного пепсі-ногена в активний пепсин відбувається аутокаталітіческі в результаті специфічного обмеженого протеолізу в присутності соляної кислоти і також пов'язане з відщепленням від профермента специфічного інгібітора пептидної природи. Ці перетворення зімогенов в активні ферменти пов'язані з конформаційними змінами молекули ферменту і формуванням активного центру або його розкриттям (демаскування). Синтез протеїназ в неактивній формі і ряду інших неактивних білків-попередників має, очевидно, певний біологічний сенс, запобігаючи руйнуванню клітин органів, в яких утворюються проферменти. Прикладами подібного активування білків є активування деяких гормонів (проінсулін -> інсулін), білка сполучної тканини (розчинний проколаген перетворюється в нерозчинний колаген), білків системи згортання крові.
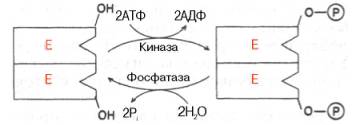
Мал. 4.23. Ковалентний модифікація ферменту шляхомфосфорилювання-дефосфо-рілірованія залишків серину.
Мал. 4.24. Нековалентні модифікація ферменту шляхом аденілірованія-деадені-вання.
Хімічна модифікація ферменту. Деякі білки при формуванні третинної структури піддаються постсинтетическом хімічної модифікації (див. Розділ 1). Виявилося, що активність ряду ключових ферментів обміну вуглеводів. зокрема фосфорілази, глікогенсінтази і ін. також контролюється шляхомфосфорилювання і дефосфорілі-вання, здійснюваного специфічними ферментами - протеїнкіназою і протєїнфосфатаза, активність яких в свою чергу регулюється гормонами (див. розділ 10). Рівень активності ключових ферментів обміну вуглеводів і відповідно інтенсивність і спрямованість самих процесів обміну визначаються співвідношенням фосфорілірованний і де-фосфорильованих форм цих ферментів.
Зазвичай розрізняють оборотну ковалентну і Нековалентні хімічні модифікації ферментів. здійснювані через ОН-групи серину. рідше - тирозину або за рахунок нековалентних взаємодій з молекулою ферменту. У першому випадку активним ферментом виявляється або фосфо-рілірованная, або дефосфорілірованном форма, як у випадку з молекулами м'язової фосфорілази і глікогенсінтази відповідно (див. Розділ 10). Як приклади можна у вигляді схеми уявити обидва типи модифікації, в якій символом Р позначається залишок фосфату. Pi - неорганічний фосфат (Н3 РО4), РРi - неорганічний пірофосфат (Н4 Р2 О7), АМФ - залишок адениловой кислоти (рис. 4.23; 4.24).
Хімічна постсинтетическом модифікація ферментів включає, крім того, процеси обмеженого протеолізу (див. Раніше), метилування (див. Розділ 13), гликозилирования, уріділірованія, аденілірованія, АДФ-рибозилювання та ін. Забезпечуючи тим самим мікроскопічний
Аллостерічеськая регуляція. У багатьох строго биосинтетических реакціях основним типом регуляції швидкості багатоступінчастого ферментативного процесу є інгібування за принципом зворотного зв'язку. Це означає, що кінцевий продукт биосинтетической ланцюга пригнічує активність ферменту. каталізує першу стадію синтезу, яка є ключовою для даної ланцюга реакції. Оскільки кінцевий продукт структурно відрізняється від субстрату. він зв'язується з аллостері-ного (некаталітичні) центром молекули ферменту. викликаючи інгібі-вання всього ланцюга синтетичної реакції.
Припустимо, що в клітинах здійснюється багатоступінчастий біосинтетичний процес, кожна стадія якого каталізується власним ферментом:
Швидкість подібної сумарною послідовності реакцій в значній мірі визначається концентрацією кінцевого продукту Р, накопичення якого вище допустимого рівня надає потужний Інги-бірующее дію на першу стадію процесу і відповідно на фермент E1.
Вперше існування подібного механізму контролю активності ферментів метаболітами було виявлено у Е.coli при дослідженні синтезу ізолейцину і ЦТФ. Виявилося, що изолейцин. є кінцевим продуктом синтезу, вибірково пригнічує активність треонин-дегідратази, що каталізує першу стадію послідовного процесу перетворення треоніну в изолейцин. що нараховує п'ять ферментативних реакцій:
Аналогічно ЦТФ як кінцевий продукт биосинтетического шляху надає інгібуючий ефект на перший фермент (аспартаткарбамоілтран-сферазу), регулюючи тим самим свій власний синтез (див. Розділ 13). Цей тип інгібування отримав назву інгібування за принципом зворотного зв'язку, або ретроінгібірованія. Існування його доведено в усіх живих організмах. В даний час він розглядається як один з провідних типів регуляції активності ферментів і клітинного метаболізму в цілому.
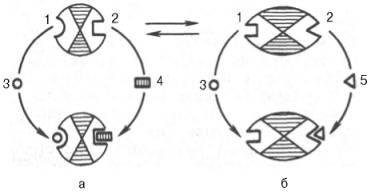
Мал. 4.25. Взаємодія алло-стеричного ферменту з субстратом і ефекторами (схема).
а - активний комплекс; б - неактивний комплекс; 1 - активний центр; 2 - аллостерічеський центр; 3 - субстрат; 4 - позитивний ефектор; 5 - негативний ефектор.
З іншого боку, в амфіболіческіх процесах, що виконують одночасно биосинтетические і біодеградатівние функції. доведено існування регуляції як за типом ретроінгібірованія, так і макроергів-тичними сполуками - індикаторами енергетичного стану клітини. Для амфіболіческіх процесів унікальним типом регуляції, властивим тільки їм, є, крім того, активація попередником. коли перший метаболіт в многоступенчатом шляху активує фермент. каталізує останню стадію. Так, доведено, що активує вплив глюкозо-6-фосфату, що є попередником глікогену. на фермент глікогенсінтази.
Подібні типи інгібування кінцевим продуктом і активування першим продуктом властиві аллостерическим (регуляторним) ферментам. коли ефектор, модулятор, структурно відрізняючись від субстрату. зв'язується в особливому (аллостеріческому) центрі молекули ферменту. просторово віддаленому від активного центру. Слід, однак, мати на увазі, що модуляторами аллостеріческіх ферментів можуть бути як активатори. так і інгібітори. Часто виявляється, що сам субстрат надає активуючий ефект. Ферменти. для яких і субстрат. і модулятор представлені ідентичними структурами, носять назву гомотропних на відміну від гетеротропних ферментів. для яких модулятор має відмінну від субстрату структуру. Взаємоперетворенням активного і неактивного аллостеріческіх ферментів в спрощеній формі, а також конфор-мационного зміни, що спостерігаються при приєднанні субстрату і ефекторів, представлені на рис. 4.25. Приєднання негативного ефектора до аллостеріческому центру викликає значні зміни конфігурації активного центру молекули ферменту. в результаті чого фермент втрачає спорідненість до свого субстрату (освіта неактивного комплексу).
Аллостерічеськіє взаємодії проявляються в характері кривих залежності початкової швидкості реакції від концентрації субстрату або ефектора, зокрема в S-образності цих кривих (відхилення від гіперболічної кривої Міхаеліса-Ментен). S-подібний характер залежності v від [S] в присутності модулятора обумовлений ефектом кооперативності. Це означає, що зв'язування однієї молекули субстрату полегшує зв'язування другий молекули в активному центрі. сприяючи тим самим збільшенню швидкості реакції. Крім того, для аллостеріческіх регуляторних ферментів характерна нелінійна залежність швидкості реакції від концентрації субстрату.
Інші типи регуляції активності ферментів. Абсолютна кількість присутнього в клітці ферменту регулюється часом його синтезу і розпаду. До регуляторних механізмів можуть бути віднесені також конкуренція ферментів за загальний субстрат. вимикання активності одного з ізоферментів (у множинних форм ферментів), вплив концентра-
ций кофакторов і явище компартментализации. Механізм Компартії-менталізаціі метаболічних процесів відіграє, мабуть, важливу біологічну роль, просторово роз'єднуючи за допомогою біомембран ферменти зі своїми субстратами (наприклад, лізосомальніферменти. Протеїнази, фосфатази. Рибонуклеази та інші гідролітичні ферменти - з цитоплазматичними речовинами. На які вони діють) . Крім того, полегшуючи незалежну регуляцію, цей механізм дозволяє розділити несумісні в одному і тому ж місці (і, можливо, в один і той же час) метаболічні процеси. Прикладом останніх можуть бути шляхи синтезу вищих жирних кислот. протікають в основному в розчинній фракції цитоплазми. і шляхи розпаду (окислення) жирних кислот. зосереджені в мітохондріях. Необхідно вказати, однак, що при будь-кому партменталізаціі виникає проблема транспорту як метаболітів. так і відновлювальних еквівалентів через біомембрани субклітинних ор-ганелл. Це завдання вирішує так званий човниковий механізм, що дозволяє переклад метаболітів в форми, здатні переходити через мембрани. і забезпечує внутрішньоклітинний гомеостаз (див. розділ 13).
