Презентація по предмету "Хімія" на тему: "ТЕМА УРОКУ« АЗОТНАЯ КИСЛОТА »Мета уроку: 1. Ознайомити учнів з фізичними та хімічними властивостями азотної кислоти як електроліту. 2. Удосконалювати.". Завантажити безкоштовно і без реєстрації. - Транскрипт:
1 ТЕМА УРОКУ «АЗОТНАЯ КИСЛОТА» Мета уроку: 1. Ознайомити учнів з фізичними та хімічними властивостями азотної кислоти як електроліту. 2. Удосконалювати практичні навички учнів з техніки та методики хімічного експерименту. 3.Весті підготовку учнів до ЗНО. Девіз уроку «знати-ЩОБ НЕ ЗАШКОДИТИ»

2 Розминка: А1. Ступінь окислення азоту в азотній кислоті А1. Ступінь окислення азоту в азотній кислоті 1) +4 2) +5 3) +2 4) +3

3 Підготовка до Е Р Е А 2. За фізичними властивостями азот і аміак А 2. За фізичними властивостями азот і аміак 1) гази 2) рідини 3) тверді речовини

4 Підготовка до ЄДІ А 3. За кількістю атомів водню азотна кислота (HNO3) А 3. За кількістю атомів водню азотна кислота (HNO3) 1) одноосновная 1) одноосновная 2) двухосновная 2) двухосновная 3) триосновна 3) триосновна 4) багатоосновними 4 ) багатоосновними

5 Підготовка до ЄДІ А4. Протонів в ядрі азоту А4. Протонів в ядрі азоту 1) 14 1) 14 2) 28 2) 28 3) 7 3) 7 4) 2 4) 2

6 Підготовка до ЄДІ А5. Речовина при дисоціації якого в водних розчинах утворюються катіони водню і аніони кислотного залишку А5. Речовина при дисоціації якого в водних розчинах утворюються катіони водню і аніони кислотного залишку 1) кислота 2) соль3) основаніе4) оксид

7 Підготовка до Е Р Е В 1. Чи вірні наступні судження про аміаку В 1. Чи вірні наступні судження про аміаку А. Аміак добре розчинний у воді. Б. У складі аміаку азот має ступінь окислення +5. 1) вірно тільки А 2) вірно тільки Б 3) вірні обидва звуження 4) обидва судження не вірні

8 Фізичні властивості HNO 3 1. Безбарвна рідина з різким запахом. 2. Концентрована азотна кислота (98% плотность1,51г / см3) на повітрі «димить», так як її пари з повітрям утворюють крапельки туману.

9 Класифікація кислоти Азотна кислота: Азотна кислота: -одноосновная-киснева-летюча -сильний електроліт - розчинна у воді

10 Отримання кислоти 1.Азотная кислота відома людині з 17 століття. 1.Азотная кислота відома людині з 17 століття. 2.Впервие вчений Глаубер отримав кислоту з селітри, діючи на неї концентрованою азотною кислотою. 2.Впервие вчений Глаубер отримав кислоту з селітри, діючи на неї концентрованою азотною кислотою. 3.Жюль Верн у книзі «Таємничий острів» описав цей метод отримання азотної кислоти. 3.Жюль Верн у книзі «Таємничий острів» описав цей метод отримання азотної кислоти.

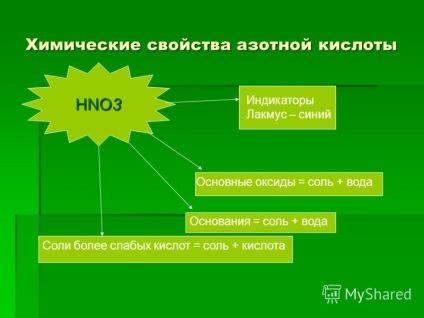
11 Хімічні властивості азотної кислоти HNO3 Індикатори Лакмус - синій Основні оксиди = сіль + вода Підстави = сіль + вода Солі слабших кислот = сіль + кислота
12 Лабораторна робота «Характерні властивості азотної кислоти як електроліту» Лабораторна робота «Характерні властивості азотної кислоти як електроліту» Правила по ТБ. Правила по ТБ. План роботи: План роботи: Опит1. Взаємодія кислоти з індикаторами. Опит1. Взаємодія кислоти з індикаторами. Дослід 2. Взаємодія кислоти з основними оксидами. (CuO + HNO 3) Досвід 2. Взаємодія кислоти з основними оксидами. (CuO + HNO 3) Досвід 3. Взаємодія кислоти з підставами. (NaOH + HNO 3) Досвід 3. Взаємодія кислоти з підставами. (NaOH + HNO 3) Дослід 4. Взаємодія кислоти з солями слабших кислот. (Na 2 CO 3 + HNO 3) Дослід 4. Взаємодія кислоти з солями слабших кислот. (Na 2 CO 3 + HNO 3)
13 Специфічні властивості азотної кислоти. 1.При нагріванні і під дією світла азотна кислота розкладається. 2. З скипидаром взаємодіє з вибухом 3.Древесние тирса, папір в концентрованої азотної кислоти спалахують. 4. При взаємодії концентрованої азотної кислоти з білком утворюється речовина яскраво-жовтого кольору, це характерна реакція на кислоту. 5.Вступает в реакцію з неметалами. (Сірої, фосфором, вуглецем)
15 Займання скипидару в концентрованої азотної кислоти.
16 Домашнє завдання: Домашнє завдання: §26 завдання 4, стор. 44. варіант 4 §26 завдання 4, стор. 44. варіант 4
17 Висновок по уроку: Азотна кислота: - сильний окислювач - як електроліт проявляє всі типові властивості сильних кислот - має специфічні властивості - треба знати властивості азотної кислоти, щоб не нашкодити собі і навколишньому середовищу. - треба знати властивості азотної кислоти, щоб не нашкодити собі і навколишньому середовищу. Матеріал, вивчений на уроці, входить в КІМ ЄДІ (по кодифікатору (1,3; 2,5; 2,11; 2,8; 2,9,2;)