3.4. Питання і завдання для самостійного рішення
1. Визначити для рівноважного газу: а); б); в) частку молекул с; г) частку молекул с. Тут - компоненти швидкості молекул уздовж осей x, y, z. - найбільш ймовірне значення.
2. Газ з молекул маси m знаходиться в рівноважному стані з температурою Т. Написати вираз для розподілу ймовірностей для компоненти швидкості молекул газу. Намалювати на одному кресленні графіки залежності для: а); б); в); г) де - деяке число. Чому рівні площі під кривими?
3. Азот знаходиться при температурі Т = 600 К. Яка ймовірність того, що молекула азоту має швидкість, точно рівну 500 м / сек. Яка ймовірність того, що швидкість молекули має значення в інтервалі від
= 499,5 м / сек до = 500,5 м / сек?
4. Записати розподіл Максвелла для в вигляді - функції від змінної
де - найбільш ймовірне значення модуля вектора швидкості. Намалювати графік залежності від щільності ймовірності
Показати на малюнку частку молекул, у яких VV0. Чому дорівнює площа під кривою?
5. Що відбувається з максимумом функції f (V) при: а) збільшенні температури газу Т; б) збільшенні маси молекул газу m. Як змінюється при цьому відносна кількість "швидких" (VV0) і "повільних" (VV0) молекул
f (V) - щільність ймовірності для модуля швидкості молекул.
6. Обчислити за допомогою розподілу Максвелла за абсолютними значеннями швидкостей молекул середнє значення зворотної швидкості.
7. Використовуючи розподіл Максвелла для (енергій)
Знайти найімовірніше 0 і середнє <> значення енергії поступального руху молекул газу при температурі Т. Знайти висоту максимуму розподілу Намалювати графік залежності F () для двох температур: Т і 2Т. При якій енергії * перетинаються криві? Чому рівні площі під кривими?
8. Чому дорівнює концентрація n молекул маси m в ізотермічної (температура Т) атмосфері планети на відстані r від її центру (r-R
R. де R - радіус планети)? Маси планети М. концентрація молекул на поверхні планети n0. Намалювати графік залежності n від r для rR.
9. Чи може планета необмежено довго утримувати ізотермічну атмосферу?
10. Ідеальний газ (маса молекул m) знаходиться в посудині об'ємом V при температурі Т. Зовнішніх силових полів немає. Знайти розподіл ймовірностей для координат і компонент швидкості молекул газу.
11. Як треба змінити відповідь до попередньої задачі, якщо газ знаходиться в зовнішньому полі, в якому потенційна енергія молекул газу одно? Записати для цього випадку.
12. Повне число молекул в газі N. Визначити N - середнє число тих молекул газу, що знаходяться в елементі об'єму V = xyz. компоненти швидкості яких належать інтервалам. Зовнішнього силового поля немає.
13. Відомо розподіл ймовірностей для вектора швидкості молекул газу. Написати вираз для вектора щільності потоку тих молекул, вектор швидкості яких належить інтервалу концентрації молекул n.
14. Написати вираження для числа молекул газу, що перетинають в позитивному напрямку осі х за час t майданчик S. перпендикулярну цій осі. Відомі: розподіл ймовірностей для компоненти швидкості молекул і концентрації молекул n.
15.На діаграмах (P, V) зображений циклічний процес, здійснюваний з ідеальним газом.
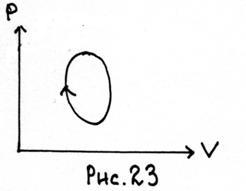
Визначити побудовою точки А і В. в яких температура газу Т мінімальна і максимальна. Визначити ділянки, на яких Т зростає і зменшується.
16. Над деякою системою зробили роботу d'A 'і повідомили їй теплоту d'Q'. Знайти роботу d'A '. яку зробила при цьому сама система і приріст dU її внутрішньої енергії.
17. При здійсненні деякої системою роботи d'A 'її внутрішня енергія зазнала приріст dU. Яка кількість d'Q 'теплоти отримала система?
18. При тиску Р приріст обсягу системи одно dV. Яку роботу d'A 'зробила система над оточуючими її тілами? Чому дорівнює d'A '. якщо обсяг системи: а) зменшується; б) збільшується? Знайти теплоту d'Q '. отриману системою, якщо приріст її внутрішньої енергії dU.
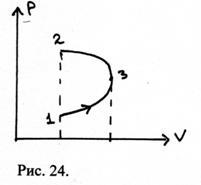
19. На діаграмі (P, V) зображений процес, який чинять деякою системою. На яких ділянках робота системи позитивна? негативна? Показати на малюнку повну роботу при переході зі стану 1 в стан 2.
20. Знайти число i ступенів свободи для молекул Нє, N2, СО2, Н2О, СН4 (молекула СО2 - лінійна; мають місце всі види рухів).
21. Число ступенів свободи i для молекул газу відомо. Використовуючи закон равнораспределенія енергії, знайти середню енергію <> молекул ідеального газу при температурі Т і його внутрішню енергію U. якщо він: а) містить N молекул; б) займає об'єм V при тиску Р. Висловити V через число молей газу.
22. Відома залежність внутрішньої енергії газу U (V, T) системи від об'єму V і температури Т. Обчислити изохорический теплоємність системи CV.
23. Ідеальний газ (показник адіабати) переводять зі стану (P1, V1) в стан (P2, V2). Знайти приріст внутрішньої енергії.
24. Повітря в кімнаті при відкритій кватирці нагріли від Т1 до Т2. Чому дорівнює приріст U внутрішньої енергії повітря, що знаходиться в кімнаті.
25. Написати рівняння стану ідеального газу в параметрах pV і Т. якщо відомі його СР і CV.
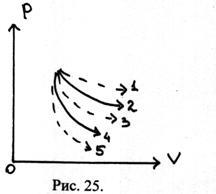
26.На діаграмі (P, V) показаний ряд процесів. Крива 2 - ізотерма; крива 4 - адіабата. Визначивши знак теплоємності С в процесах 1, 3, 5. Чому дорівнює теплоємність в процесах 2 і 4?
27. Деяка система при температурі Т отримує елементарне кількість теплоти d'Q. Вказати зв'язок між цими величинами і збільшенням ентропії dS системи, якщо процес: а) квазістатичний; б) квазістатичний.
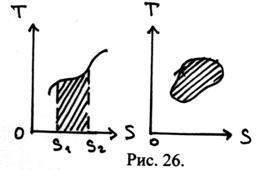
28. На діаграмі (T, S) зображений деякий квазістатичний процес. Чому дорівнює заштрихованная площа?
29. У початковий момент часу деяка замкнута система неравновесна. Як будуть змінюватися за часом ймовірність w макросостоянія системи і її ентропія S. Зобразити якісно залежність S (t) і показати на малюнку час релаксації системи.
30. Чи можна перерахувати мікростану при класичному їх описі у системи, що складається з N частинок?
31. За допомогою ентропії S ідеального газу обчислити приватні похідні і, де V - об'єм, U - внутрішня енергія ідеального газу.
32. Розглянемо замкнуту систему, що складається з двох рівноважних підсистем з постійними обсягами і кількістю частинок. Підсистеми можуть обмінюватися теплотою. Показати, що одним з необхідних умов равновесности стану системи є рівність температур підсистем.
33. молей ідеального газу з показником адіабати переводять зі стану, в якому його тиск Р1 і обсяг V1. в стан, в якому його тиск Р2 і обсяг V2. Визначити приріст ентропії газу S. Розглянути випадки, коли обидва стану лежать на: а) однієї ізобарі; б) на одній Ізохор; в) на одній изотерме; г) на одній адіабаті.
34. У скільки разів збільшиться статистичний вага одного моля ідеального газу при ізотермічному збільшенні його обсягу в два рази?
35. Оцінити середнє число молекул
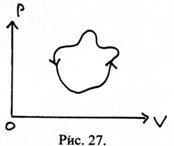
36. На малюнку зображений циклічний процес, здійснюваний з робочим тілом в деякому пристрої. Що це за пристрій: теплова машина або холодильник?
37. Чи може теплова машина, яка використовує цикл Карно, бути незворотною? Сформулювати достатні умови оборотності такої машини.
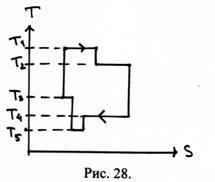
38. Скільки нагрівачів і холодильників, і з якими температурами необхідно для реалізації теплової машини, що використовує цикл, зображений на малюнку 28.
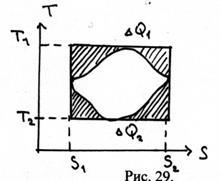
39. Обчислити к. П.д. циклу, зображеного на малюнку 29. Відомі Т1, Т2, S1. S2 і заштриховані площі Q1 і Q2.
40. Оборотна теплова машина за цикл споживає від нагрівача теплоту Q1 і передає холодильнику теплоту Q2. Яку роботу А треба зробити над цією машиною, щоб, працюючи в режимі теплового насоса, вона "викачала" з холодильника теплоту Q. Яку теплоту QН отримає при цьому нагрівач?
4.1. відповіді
1. а) 0; б) 0; в) ½; г) 1/8.
7. (адіабатичний процес).
Так як і те і
8. При "склеюванні" половини молекул утворюється пар виділяється енергія. Тоді енергія газу складе і температуру Т1 можна знайти (з урахуванням "двоатомний" склеєних молекул)
Таким чином . Ставлення тисків визначається як відношення температур.
3.5. Контрольні питання
1. Що називають термодинамічною системою?
2. Що таке стан термодинамічної системи?
3. Який набір параметрів визначає стан системи?
4. Яка термодинамічна система є однорідною?
5. Що таке термодинамічна рівновага?
6. Яка термодинамічна система називається рівноважної?
7. Що таке макроскопічна система?
8. Які труднощі виникають при описі макроскопічної системи механічними методами?
9. Які параметри системи називаються макроскопічними?
10. Які параметри системи називаються мікроскопічними?
11. Як отримати значення макроскопічних параметрів, якщо відомі мікроскопічні параметри?
12. У чому полягає метод середньостатистичного середнього?
13. Що називають щільністю ймовірності?
14. Що таке відносна флуктуація?
15. Що таке квадратична флуктуація?
17. Яким властивістю повинна володіти фізична величина, щоб її відносна флуктуація підпорядковувалася теоремі про відносну флуктуації?
18. Які системи називають квазізамкненого і квазінезавісімимі?
19. Якими параметрами характеризується стан статистичної системи?
20. Що називається функцією статистичного розподілу?
21. Який фізичний зміст розподілу Гіббса?
22. Яку роль відіграє розподіл Гіббса в статистичній фізиці?
23. Як обчислити середнє значення параметра за допомогою розподілу Гіббса для випадку дискретного розподілу енергії?
24. Як обчислити середнє значення параметра за допомогою розподілу Гіббса для випадку безперервного розподілу енергії?
25. Що таке ентропія в статистичній фізиці?
26. Як обчислюється ентропія в статистичній фізиці?
27. Яким умовам задовольняє статистична ентропія?
28. У чому полягає особливість ентропії для систем, що знаходяться в стані термодинамічної рівноваги?
29. Як пов'язані між собою енергія, ентропія і температура?
30. Якими властивостями володіє модель "ідеальний газ"?
31. Як виглядає розподіл ймовірностей по імпульсах для молекули ідеального газу?
32. Чому дорівнює середньоквадратична швидкість?
33. Чому дорівнює середня кінетична енергія атома?
34. Як виглядає формула Больцмана?
35. З яким процесом пов'язана зміна внутрішньої енергії індивідуальних частинок, при якому не змінюється розподіл ймовірностей термодинамічної системи?
36. З яким процесом пов'язана зміна внутрішньої енергії індивідуальних частинок, при якому змінюється розподіл ймовірностей термодинамічної системи?
37. Як виглядає розподіл Максвелла за компонентами швидкостей молекули?
38. Як виглядає розподіл Максвелла за абсолютними значеннями швидкостей молекули?
39. Що таке ступеня свободи?
40 Що таке число ступенів свободи?
42. У чому особливості ступенів свободи коливального руху?
43. Як виглядає вираз для загального числа ступенів свободи?
44. Як виглядає формула для середньої енергії лінійної молекули, що складається з n атомів?
45. Як виглядає формула для середньої енергії фор нелінійної молекули, що складається з n атомів?
46. Що таке константа Больцмана?
47. Перерахувати основні поняття термодинаміки.
48. Перерахувати основні термодинамічні параметри стану тіла.
49. Дати визначення теплоти.
50. Дати визначення кількості теплоти.
51. Що таке теплообмін?
52. Як визначається температура?
53. Що таке абсолютна і емпірична температури?
54. Як виміряти емпіричну температуру?
55. Як виміряти абсолютну температуру?
56. Що таке термодинамічна шкала, в чому її відмінність від всіх інших температурних шкал?
57. Чи можна стаціонарний стан системи вважати рівноважним?
58. Що таке рівняння стану?
59. Як виглядає рівняння стану ідеального газу?
60. Що таке термодинамічний процес?
61. Який процес називають рівноважним?
62. Чи можна рівноважний процес вважати оборотним?
63. Як реалізувати рівноважний процес?
64. Що таке квазістатичний процес?
65. Дати формулювання О - початку термодинаміки.
66. Дати формулювання 1 - початку термодинаміки.
67. Дати формулювання 2 - початку термодинаміки.
68. Дати формулювання 3 - початку термодинаміки.
69. Дати визначення внутрішньої енергії ідеального газу.
70. Як визначається елементарна робота в термодинаміці.
71. Що означає, що зміна внутрішньої енергії є повним диференціалом?
72. Довести, що зміна кількості теплоти і роботи не є повними диференціалами?
73. Як виглядає перший початок термодинаміки для изохорический процесу?
74. Як виглядає перший початок термодинаміки для изобарического процесу?
75. Як виглядає перший початок термодинаміки для ізотермічного процесу?
76. Як виглядає перший початок термодинаміки для адіабатичного процесу?
77. Чому дорівнює робота в ізотермічному процесі?
78. Чому дорівнює робота в ізобаріческом процесі?
79. Чому дорівнює робота в адіабатичному процесі?
80. Чому дорівнює робота в ізохоричному процесі?
81. Який термодинамічний процес називається циклічним?
82. У чому особливість внутрішньої енергії в термодинамічній процесі?
83. Як виглядає модель теплової машини?
84. Як виглядає модель холодильної машини?
85. За яких умов теплової машиною можна користуватися як холодильної?
86. Що таке оборотна теплова машина?
87. Чому дорівнює коефіцієнт корисної дії теплової машини
88. Чому дорівнює коефіцієнт корисної дії холодильної машини?
89. Що таке наведена теплота?
90. Чому дорівнює коефіцієнт корисної дії циклу Карно?
91. Що таке цикл Карно?
92. У чому особливість циклу Карно в порівнянні з іншими циклами?
93. Що таке термодинамічна ентропія?
94. У чому особливість поведінки ентропії в замкнутій системі?
95. Як виглядає перший початок термодинаміки з використанням величини ентропії.
96. Що таке пов'язана енергія?
97. Що являють за змістом термодинамічні потенціали?
98. Написати вираження для вільної енергії.
99. Написати вираження для потенціалу Гіббса.
100. В чому полягає зв'язок термодинамічної і статистичної ентропії і в чому статистичний сенс другого початку термодинаміки.
Використовувана література
2. Григулевич. М. 1988, Світ.
3. Клайн Н. Математика. Пошук істини. М. 1 988.
5. Аристотель. Твори. Т. 3. М. тисяча дев'ятсот вісімдесят-одна.
6. Стрільців. М. 1975.
7. Спаський для філософів. МГУ, 1988.
8. Тамм теорії електрики. М. 1 988.
9. Козелецький Ю. Психологічна теорія рішень. М. 1979, Прогрес.
11. Яковлєв завдань по загальному курсу фізики. Ч. I. М. 1960.
12. Фізичний енциклопедичний словник. М. Радянська енциклопедія, 1983.
15. Путілов фізики. Т. I, II. М. 1954 вид. Техн. теор. літ-ри.
16. Левич теоретичної фізики. Т. 1. М. 1962 Физматгиз.
17. Лівшиць фізика. М. 1964 вид. Наука.
18. Лауе М. Історія фізики. М. +1956.
19. Про можливе і неможливе в науці. М. 1 988.
21. Попов за рішенням завдань молекулярної фізики.