Кипіння є фазовий перехід, при якому відбувається перетворення рідини в пар, причому бульбашки пара утворюються у всьому об'ємі рідини.
Температурою кипіння рідини називають ту температуру, при якій тиск насиченої пари над даною рідиною дорівнює зовнішньому. При цій температурі і відповідному їй тиску насиченої пари встановлюється рівновага між рідкою і газоподібною фазами (швидкість випаровування дорівнює швидкості конденсації), і обидві ці фази можуть співіснувати протягом тривалого часу. Якщо рідина - індивідуальна речовина і зовнішній тиск не змінюється, то кипіння її у відкритому посуді відбувається при постійній температурі до тих пір, поки повністю не зникне рідка фаза. Температура, при якій дана рідина кипить в умовах тиску 101325 Па, називають нормальною температурою кипіння.
Замерзання (затвердіння) являє собою фазовий перехід, при якому відбувається перетворення рідини на тверду речовину, частинки якого (кристали) утворюються у всьому об'ємі рідини.
Температурою замерзання (кристалізації) рідини називають ту температуру, при якій тиск насиченої пари над рідиною дорівнює тиску насиченої пари над випадають з неї кристалами твердої фази. При цій температурі і відповідному їй тиску насиченої пари встановлюється рівновага між рідкою і твердою фазами (швидкість кристалізації дорівнює швидкості плавлення) і обидві ці фази можуть співіснувати протягом тривалого часу. Якщо рідина - індивідуальна речовина і зовнішній тиск залишається постійним, то при її охолодженні температура буде залишатися незмінною, що відповідає температурі замерзання, до тих пір, поки не відбудеться повне затвердіння.
Для того, щоб змістити рівновагу в бік кристалізації треба знизити температуру, тому що кристалізація - це екзотермічний процес. Якщо розчинити в рідині якусь речовину, концентрація її зменшиться і в системі рідина - тверда фаза посилиться процес плавлення. Звідси випливає залежність (II закон Рауля):
Підвищення температури кипіння, а також зниження температури кристалізації розбавлених розчинів прямо пропорційно молекулярний розчину і не залежить від природи речовини.
де: ІК - ебулліоскопіческая і кріоскопічна константи (залежать від природи розчинника, що не залежать від природи речовини і концентрації)
Властивості і механізми формування рідких розчинів різноманітні, тому створення єдиної теорії розчинів пов'язано зі значними труднощами. Відомі кілька точок зору на природу розчинів: фізична, хімічна та комплексна.
Механізм розчинення в рамках комплексної моделі можна представити у вигляді трьох стадій: 1) орієнтація полярних молекул розчинника навколо частинок речовини, що розчиняється, освіту іон - дипольних зв'язків; 2) розрив зв'язків в розчиняється речовини; 3) сольватация іонів в розчині.
Дві перші стадії пов'язані з витратою енергії, а третя з її виділенням. Співвідношення енергій визначає теплоту розчинення, і тим самим екзотермічність або ендотермічну процесу розчинення.
Відомо, що за своєю структурою рідини займають проміжне положення між газами, в яких молекули розташовуються хаотично, і кристалами, де частинки знаходяться на певних відстанях один від одного в вузлах кристалічної решітки. У рідинах зберігаються деякі елементи впорядкованої структури. Наприклад, вважається, що вода частково зберігає структуру льоду, в якому кожна молекула має водневі зв'язку з чотирма сусідніми молекулами.
При утворенні розчину внаслідок появи нових сил взаємодії між частинками структура чистих рідин порушується. Виникає нова структура з іншим розташуванням частинок і іншим взаємодією між ними. Все це сильно впливає на процеси, що протікають в розчинах.
Властивості розчину істотно залежать від його складу. Тому найважливішими характеристиками розчину є концентрації його компонентів. Способи вираження концентрацій різні. Частіше за інших використовують:
1. Молярну частку - відношення кількості i - компонента ni. що міститься в розчині, до загального кількості речовини в системі n 1.
2.Об'емная частка - відношення обсягу, займаного i - компонентом Vi. до загального обсягу системи V.
3. Масова частка - відношення маси i - компонента (mi) до загальної маси системи m.
4. Молярна концентрація - відношення кількості i - компонента ni. до об'єму, що займають системою V.
Молярна концентрація висловлюють в моль / м 3. моль / л. Допускається позначення М.
5. Моляльна концентрація або моляльність - відношення кількості i - компонента ni. до маси розчинника mр.
Моляльну концентрацію висловлюють в моль / кг. Наприклад, під терміном «одномоляльний розчин» розуміється розчин, що містить 1 моль розчиненої речовини в 1 кг розчинника.
6. Молярная концентрація еквівалента - відношення кількості еквівалентів i речовини, до об'єму, що займають системою.
Молярна концентрація еквівалента висловлюють в моль / м 3. моль / л. Допускається позначення н.
При внесенні речовини, що розчиняється в розчинник процес розчинення яке - той час йде мимоволі, тобто розчин залишається ненасиченим, значить в розчин може переходити ще кілька речовини. Коли розчин стає насиченим, то в такій системі невизначено довго можуть співіснувати без будь - яких змін розчин і надлишок речовини, що розчиняється. Рівноважний стан може бути порушено тільки в результаті зміни температури, тиску або введення інших речовин. У перенасиченому розчині концентрація речовини вище, ніж в насиченому (при даній температурі і тиску), його можна приготувати обережним і повільним охолодженням насиченого при високій температурі розчину солі слабкої кислоти (тиосульфатов і ацетатів лужних металів). Перенасичений розчин являє собою систему, що знаходиться в уявній рівновазі. Струшування або внесення в нього кристалів того ж речовини, що знаходиться в розчині, викликає кристалізацію, відбувається виділення надлишку розчиненого речовини, і розчин стає насиченим.
Розчинність даного речовини дорівнює його концентрації в насиченому розчині. Для різних речовин вона коливається в значних межах. Абсолютно нерозчинних речовин немає. Розчинність залежить від природи речовини, його агрегатного стану і зовнішніх умов (температури, тиску та ін.). При розчиненні деяких речовин має місце контрактація - стиснення обсягу системи: обсяг розчину виходить трохи менше суми обсягів речовини, що розчиняється і розчинника. Так, при змішуванні 48 обсягів води з 52 обсягами етилового спирту при температурі 293К замість 100 обсягів суміші виходить тільки 96,3. Це пояснюється взаємодією спирту і води з утворенням гідратів, а також взаімоуплотненіем їх молекул в просторі.
Гази здатні розчинятися в рідинах, але не безмежне, а до певної межі, відповідного утворення насиченого розчину. Після досягнення стану насичення встановлюється динамічна рівновага між розчином і знаходяться над ним газом. Ця рівновага характеризується тим, що в одиницю часу число молекул газу, що входять в рідину через її поверхню, дорівнює кількості молекул газу, що виходять з рідини.
Розчинення газів майже завжди супроводжується виділенням теплоти (внаслідок сольватації їх молекул). Згідно з принципом Ле Шательє, розчинність газів знижується при підвищенні температури і збільшується при охолодженні.
Закон Генрі (1803) висловлює залежність розчинності газів від тиску: розчинність даного газу в рідині пропорційна його тиску над рідиною: С = Кр,
де с - концентрація газу в рідині, до - коефіцієнт пропорційності, що залежить від природи газу, р - тиск газу над розчином.
Обсяг розчиненого газу не залежить від зовнішнього тиску, оскільки при збільшенні тиску в однакове число разів зростає концентрації розчиненого газу і газу над розчином. Таким чином, розчинність газу в рідині пропорційна його парціальному тиску.
Парціальний тиск азоту приблизно в 4 рази перевищує парціальний тиск кисню. Тому в міру збільшення тиску розчин збагачується азотом.
Ідеальними будуть такі розчини, утворення яких з компонентів, узятих в однаковій агрегатному стані і в будь-яких співвідношеннях, не супроводжується зміною обсягу і тепловим ефектом, а зміна ентропії дорівнює зміні ентропії при змішуванні ідеальних газів:
Закон Дальтона: При розчиненні суміші газів в рідині кожен газ розчиняється прямо пропорційно своєму парціальному тиску.
Залежно від природи рідин, що становлять систему, розрізняють:
системи, що складаються з необмежено змішуються рідин (вода і етиловий спирт, вода і оцтова есенція)
системи, що складаються з рідин обмежено розчиняються один в одному (вода і анілін, вода і ефір)
системи з практично нерозчинних одна в одній рідин (вода і бензин, вода і ртуть).
Температура, при якій обмежена розчинність переходить в необмежену, називається критичною температурою розчинення.
Взаємну розчинність компонентів можна підвищити або знизити введенням третього компонента.
Наприклад, анілін може необмежено змішуватися з водою при всіх температурах, якщо в системі присутня достатня кількість йодиду літію (т. К. Ця сіль однаково добре розчиняється в обох рідинах). Іноді введення третього компоненту дозволяє перевести однорідний розчин в двофазний. Наприклад, для того щоб виділити етиловий спирт з його водного розчину, досить додати кристалічний поташ і енергійно струснути. Після відстоювання розчин розділяється на два змішуються шару.
Як правило, розглядаються розчини твердих речовин в рідинах. Властивості розчинів підкоряються трьом закону сформульованим Раулем і четвертим - Вант Гофф.
Властивості розбавлених розчинів не залежать від природи речовини, а залежать тільки від його концентрації називаються Колігативні. До них відносяться осмотичний тиск, зниження тиску насиченої пари над розчином, зниження температури кристалізації і підвищення температури кипіння розчину.
Відповідно до закону Рауля тиск насиченої пари над розведеним розчином нижче, ніж над чистим розчинником.
Важливу роль в організмі рослин і тварин грає явище осмосу. Осмос - процес однобічної дифузії розчинника крізь напівпроникну мембрану від розчину з меншою концентрацією до розчину з більшою концентрацією.
У розведених розчинах осмос не залежить в явній формі від виду розчиненої речовини і розчинника. Вирішальне значення має концентрація розчину. Матеріали, крізь які проходить розчинник і не проходить розчинена речовина, називають напівпроникними.
Рівняння Вант - Гоффа:
Величина осмотичного тиску залежить від концентрації розчиненого речовини.
Порушення осмосу і зміна осмотичного тиску в організмі веде до небажаних наслідків. Зниження осмотичного тиску викликається введенням в організм великої кількості надлишкової води або в результаті втрати солей, наприклад з потом. Воно може викликати блювоту, судоми, а в тяжких випадках - привести до загибелі організму. Підвищений осмотичний тиск пов'язаний з введенням в організм надлишку солей і перерозподілом води, в результаті в тканинах накопичується надлишок солей і виникають набряки.
Осмотичний тиск є однією з причин руху води рослинах і її підйому від коренів до вершини. З листя рослин під дією атмосферних процесів вода випаровується, її втрата компенсується осмотическим всмоктуванням з клітин стебла.
Розчин на відміну від чистого розчинника, не замерзає при постійній температурі. Кристали починають виділятися при якій - то однієї температурі, у міру зниження температури кількість їх зростає, поки весь розчин не перетвориться в тверду фазу. Температуру, при якій в результаті охолодження розчину починається утворення кристалів, називають температурою замерзання розчину. при температурі замерзання кристали розчинника знаходяться в рівновазі з розчином даного складу.
Досвід показує, що розбавлений розчин замерзає при більш низькій температурі, ніж чистий розчинник. Різниця між температурами замерзання розчинника і розчину отримала назву зниженням температури замерзання # 916; t.
k - кріоскопічна константа. Це величина чисельно рівна зниження температури замерзання одномоляльного розчину за умови, що він залишається ідеальним. а розчинена речовина не дисоціює і не асоціює. Кріоскопічна константа залежить від природи розчинника і не залежить від природи розчиненої речовини. Для води - 1,86; для фенолу - 7,27, для бензолу - 5,10 ККГ / моль. Це означає, що при розчиненні в цих розчинниках одного і того ж речовини рівній концентрації максимальне зниження температури замерзання буде спостерігатися в фенолу, найменше в воді.
В результаті зниження тиску пара над розчином нелетучего речовини підвищується температура кипіння розчину. Наявність розчиненого речовини викликає підвищення температури кипіння розчину.
Е - ебулліоскопіческая постійна. Вона залежить тільки від розчинника. Для води 0,51, фенолу - 3,04.
Необхідно пам'ятати, що температура кипіння розчинів вище в порівнянні з температурою кипіння води. Тому опіки від киплячих розчинів більш болючі, ніж опіки від киплячих розчинників.
Лекція 4 «Електролітична дисоціація у водному розчині»
Речовини - електроліти це:
1. розчинні підстави - лугу,
2. кислоти,
3. розчинні солі.
Оксиди до електролітів не належать, т. К. Вони не просто розчиняються у воді, а вступають з нею в хімічну реакцію, утворюючи гідроксид, який і діссоціірует.Нередко зустрічаються речовини, в молекулах яких спостерігається два види зв'язку. Наприклад, в гидроксиде натрію - NaOH натрій пов'язаний з гидроксогрупп іонним зв'язком, а водень з киснем - ковалентного. У молекулі сірчаної кислоти H2 SO4 зв'язок водню з кислотним залишком більш полярна, ніж зв'язок сірки з киснем. У нітрат алюмінію Al (NO3) 3 алюміній пов'язаний з кислотним залишком іонним зв'язком, а атоми азоту з атомами кисню - ковалентного. У таких випадках розпад молекули на іони відбувається за місцем іонної або найбільш полярного зв'язку, для розщеплення яких потрібно менше енергії.
Зі сказаного випливає, що іони можуть бути утворені не тільки з окремих атомів, а й груп атомів. Наприклад SO4 2-. NO3 -. OH -.
Для кількісної характеристики електролітичноїдисоціації вводиться поняття ступеня дисоціації (a):
a = -----. де n - число молекул вешества, що розпалися на іони;
N N - число молекул речовини, введеного в розчин.
Залежно від ступеня дисоціації всі електроліти умовно ділять на сильні (a = 1) і слабкі (a<1). Степень диссоциации зависит от природы электролита, температуры и концентрации раствора.
До сильних електролітів належать: сильні мінеральні кислоти НСl, H2 SO4. HNO3. HMnO4 і ін. Гідроксиди лужних і лужно-земельних металів, і все розчинні солі.
До слабких електролітів належать: практично всі органічні речовини, слабкі кислоти H2 CO3. H2 S, HNO2. H2 SiO3. H3 PO4, що залишилися підстави, і багато бінарні сполуки Н2 О, оксиди і ін.
При написанні рівнянь електролітичноїдисоціації необхідно враховувати, що:
дисоціація многоосновних кислот і многокіслотних підстав відбувається поступово;
рівняння дисоціації сильних електролітів по першій ступені записують, як незворотний процес, а по всім наступним - як оборотний (виняток гідроксиди лужних і лужно-земельних металів).
слабкі електроліти дисоціюють оборотно по всіх щаблях:
Амфотерні гідроксиди є слабкими електролітами і диссоциируют як за типом підстави, так і за типом кислоти:
Для характеристики слабких електролітів застосовують величину, звану константою дисоціації.
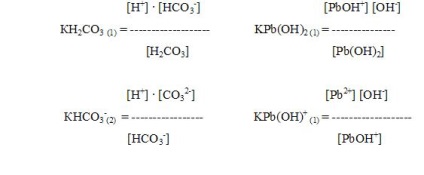
Константа дисоціації і ступінь дисоціації знаходяться в математичної залежності (закон розведення). зі зменшенням концентрації розчину (С) ступінь дисоціації (a) електроліту зростає.
Із закону розведення можуть бути отримані формули, що зв'язують константу дисоціації слабкого електроліту, ступінь дисоціації і концентрацію іона (Сіону). Дійсно, так як
Неважко бачити, що також Сіону = a С і Сіону = К / С.