Безбарвна летка масляниста рідина, t ° пл. = 17 ° C; t ° кип. = 66 ° С; на повітрі «димить», сильно поглинає вологу (зберігають в запаяних судинах).
SO 3 добре розчиняється в 100% -ної сірчаної кислоти, цей розчин називається олеумом.
1) Сірчаний ангідрид - кислотний оксид.
Взаємодія з водою
При розчиненні в воді дає сильну двухосновную сірчану кислоту:
Дисоціація протікає східчасто:
H 2 SO 4 → H + + HSO 4 - (перший ступінь, утворюється гидросульфат - іон)
HSO 4 - → H + + SO 4 2- (другий ступінь, утворюється сульфат - іон)
H 2 SO 4 утворює два ряди солей - середні (сульфати) і кислі (гидросульфати)
Взаємодія з лугами
NaOH + SO 3 (надлишок) → NaHSO 4
Взаємодія з основними оксидами
Фізичні властивості сірчаної кислоти:
Важка масляниста рідина ( "купоросне масло");
щільність 1,84 г / см3; нелетка, добре розчинна у воді - з сильним нагріванням; t ° пл. = 10,3 ° C, t ° кип. = 296 ° С, дуже гігроскопічна, має водовіднімаючих властивостями (обвуглювання паперу, дерева, цукру).
Теплота гідратації настільки велика, що суміш може скипати, розбризкується і викликати опіки. Тому необхідно додавати кислоту до води, а не навпаки, оскільки при додаванні води до кислоти легша вода виявиться на поверхні кислоти, де і зосередиться вся теплота, що виділяється.
Промислове виробництво сірчаної кислоти (контактний спосіб):
Подрібнений очищений вологий пірит (сірчаний колчедан) зверху засипають в піч для випалу в "киплячому шарі". Знизу (принцип протитоку) пропускають повітря, збагачений киснем.
З печі виходить пічної газ, склад якого: SO2. O2. пари води (пірит був вологий) і дрібні частки недогарка (оксиду заліза). Газ очищають від домішок твердих частинок (в циклоні і електрофільтрі) і водяної пари (в сушильній башті).
У контактному апараті відбувається окислення сірчистого газу з використанням каталізатора V 2 O 5 (пятиокись ванадію) для збільшення швидкості реакції. Процес окислення одного оксиду в інший є оборотним. Тому підбирають оптимальні умови протікання прямої реакції - підвищений тиск (т.к пряма реакція йде зі зменшенням загального обсягу) і температура не вище 500 С (т.к реакція екзотермічна).
У поглотительной вежі відбувається поглинання оксиду сірки (VI) концентрованої сірчаної кислотою.
Поглинання водою не використовують, т.к оксид сірки розчиняється в воді з виділенням великої кількості теплоти, тому що утворюється сірчана кислота закипає і перетворюється на пару. Для того, щоб не утворювалося сірчанокислотного туману, використовують 98% -ну концентровану сірчану кислоту. Оксид сірки дуже добре розчиняється в такий кислоті, утворюючи олеум: H2 SO4 · nSO3
Хімічні властивості сірчаної кислоти:
H2 SO4 - сильна двухосновная кислота, одна з найсильніших мінеральних кислот, через високу полярності зв'язок Н - О легко розривається.
1) У водному розчині сірчана кислота дисоціює. утворюючи іон водню і кислотний залишок:
H2 SO4 = H + + HSO4 -;
HSO4 - = H + + SO4 2-.
Сумарне рівняння:
H2 SO4 = 2H + + SO4 2-.
2) Взаємодія сірчаної кислоти з металами:
Розбавлена сірчана кислота розчиняє тільки метали, що стоять у ряді напруг лівіше водню:
Zn 0 + H2 +1 SO4 (разб) → Zn +2 SO4 + H2
5) Обмінні реакції з солями:
BaCl2 + H2 SO4 → BaSO4 ↓ + 2HCl
Освіта білого осаду BaSO4 (нерозчинного в кислотах) використовується для виявлення сірчаної кислоти і розчинних сульфатів (якісна реакція на сульфат іон).
Особливі властивості концентрованої H2 SO4:
1) Концентрована сірчана кислота є сильним окислювачем; при взаємодії з металами (крім Au, Pt) відновлюватися до S +4 O2. S 0 або H2 S -2 залежно від активності металу. Без нагрівання не реагує з Fe, Al, Cr - пассивация. При взаємодії з металами, що володіють змінною валентністю, останні окислюються до більш високих ступенів окислення. ніж у випадку з розведеним розчином кислоти: Fe 0 → Fe 3+. Cr 0 → Cr 3+. Mn 0 → Mn 4+, Sn 0 → Sn 4+
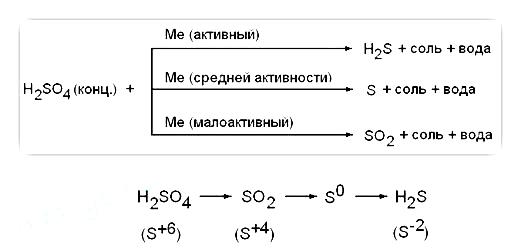
Метал середньої активності
2) Концентрована сірчана кислота окисляє деякі неметали як правило до максимальному ступені окислення, сама відновлюється доS + 4O2:
3) Окислення складних речовин:
Сірчана кислота окисляє HI і НВг до вільних галогенів:
2 КВr + 2Н2 SO4 = К2 SО4 + SO2 + Вr2 + 2Н2 Про
2 КI + 2Н2 SО4 = К2 SO4 + SO2 + I2 + 2Н2 Про
Концентрована сірчана кислота не може окислити хлорид-іони до вільного хлору, що дає можливість отримувати НСl по реакції обміну:
NаСl + Н2 SO4 (конц.) = NаНSO4 + НСl
Сірчана кислота віднімає хімічно зв'язану воду від органічних сполук, що містять гідроксильні групи. Дегідратація етилового спирту в присутності концентрованої сірчаної кислоти призводить до отримання етилену:
С2 Н5 ОН = С2 Н4 + Н2 О.
Обвуглювання цукру, целюлози, крохмалю та ін. Вуглеводів при контакті з сірчаною кислотою пояснюється також їх обезводненням:
C6 H12 O6 + 12H2 SO4 = 18H2 O + 12SO2 ↑ + 6CO2 ↑.