Пом'якшення води - процес зниження жорсткості води, тобто зменшення концентрації іонів кальцію і магнію.
Методи пом'якшення води:
· Термічне пом'якшення води
· Реагентне пом'якшення води
Термічне пом'якшення води засновано на нагріванні води, дистиляції, і виморожування. Тимчасова жорсткість води, що утворюється гідрокарбонатами кальцію і магнію, повністю усувається при кип'ятінні протягом години. В процесі кип'ятіння розчинні гідрокарбонати переходять у нерозчинні карбонати, що випадають у вигляді білого осаду або накипу, з виділенням при цьому вуглекислого газу. Жорсткість води практично повністю видаляється при термічній перегонці (дистиляції) води, оскільки катіони і аніони не переходять в пар.
Реагентне пом'якшення води. Застосовуються два методи хімічного пом'якшення води: вапняний і вапняно-содовий. Дані методи очищення води засновані на перекладі іонів Са 2+ і Мg 2+ в з'єднання з обмеженою розчинністю: карбонат кальцію СаСО3 і гідроксид магнію Мg (ОН) 2.
Грубе пом'якшення води (приблизно до 0,3 ммоль / дм 3) виробляють додаванням вапна, їдкого натру або соди (вапняно-содовий метод):
З гашеним вапном реагує також розчинена у воді двоокис вуглецю СО2:
Як умягчителя застосовується також тринатрийфосфат Na3 PO4. усуває тимчасову і постійну жорсткість, і дозволяє отримати більш повне пом'якшення (до 0,015 ммоль / дм 3). Тринатрійфосфат входить до складу сучасних пральних порошків.
Іонний обмін. Іонний обмін і іонообмінні смоли застосовуються з 60 років. Іонообмінні смоли (сорбенти - іоніти) - тверді, нерозчинні, речовини у вигляді дрібнодисперсних кульок. В основі цих смол лежить синтетична матриця (каркас), що містить позитивний або негативний заряд, і противоион, компенсуючий заряд матриці. Очищення води відбувається в результаті обміну речовин (позитивно або негативно заражених) матриці іонообмінної смоли на елементи розчинених у воді забруднень. Таким чином, концентрація розчинених забруднень істотно падає. Згодом, під час регенерації систем водопідготовки, накопичені забруднення з води скидаються в дренаж.
При невеликих перевищення жорсткості води і сухого залишку у воді, застосовують натрій - катіонітових смолу. При проходженні жорсткої води через Катіонообменная смолу відбувається обмін катіонів Ca 2+ і Mg 2+ на катіони Na +. які входять до складу смоли, таким чином, катіони Ca 2+ і Mg 2+ залишаються на смолі, а катіони Na + переходять в зм'якшувати воду. Згодом все катіони Na + обмінюються на катіони жорсткості, катіонообменная смола втрачає здатність зм'якшувати воду і її необхідно регенерувати. Для цього смола промивається розчином кухонної солі NaCl, в результаті чого відбувається процес, зворотний пом'якшення: катіони натрію переходять до складу смоли, при цьому витісняючи катіони кальцію і магнію в промивну воду, зливає в дренаж (каналізацію). Після цього збагачена натрієм смола ставати знову готової до пом'якшення.
Для повного знесолення (деионизации) води після катионитового фільтра її пропускають через аніонітових. Як анионитов використовуються смоли, отримані в результаті взаємодії амінів з формальдегідом або поліетиленполіамін з епіхлоргідрином.
Змішуючи зерна катіоніту і аніоніти, можна виробляти одночасне витяг катіонів та аніонів з води.
Мембранні методи очищення води - фільтрація через спеціальні мембрани. Залежно від розміру пор мембрани розрізняють мікрофільтрацію, ультрафільтрацію і нанофільтрацію. Мікрофільтрація дозволяє виділити домішки розміром вище 0,1 мкм; застосовується в медицині, харчовій промисловості на підприємствах виробляють алкогольні і безалкогольні напої, для очищення води в системах водопідготовки. Ультрафільтраційні мембрани мають розмір пір від 20 до 1000 A (або 0,002-0,1 мкм) і дозволяють затримувати тонкодисперсні і колоїдні домішки, макромолекули (нижня межа молекулярної маси становить кілька тисяч), водорості, одноклітинні мікроорганізми, цисти, бактерії і віруси і т . Д. Нанофільтрація застосовується для одержання особливо чистої води, очищеної від бактерій, вірусів, мікроорганізмів, колоїдних частинок органічних сполук (в тому числі пестицидів), молекул солей важких металів, нітратів, нітритів та інших шкідливих домішок.
Зворотний осмос. Дані установки і методи очищення води почали використовуватися 1960. Осмос - мимовільний перехід речовини через напівпроникну мембрану, що розділяє два розчини з різною концентрацією або розчин і чистий розчинник. У загальному випадку розчинена речовина з розчину з високою концентрацією намагається перейти в розчин з низькою концентрацією. Якщо підвищити тиск в розчині з низькою концентрацією, то потік розчиненого речовини припиниться. Різниця тисків, що припиняє перетікання речовини (фільтрацію) через мембрану, називається осмотичним тиском. Осмотические явища надзвичайно поширені в рослинному і тваринному світі. Осмос забезпечує проникнення поживних речовин в клітину і виведення в міжклітинну середу продуктів життєдіяльності. Зворотним осмосом називають метод поділу розчинів, в якому очищається вода подається під тиском 3-8 МПа на напівпроникну мембрану, при цьому вода фільтрується через пори, а розчинена речовина залишається.
Вода, що пройшла очищення методом зворотного осмосу або нанофільтрації за своїми властивостями дуже близька до талої води стародавніх льодовиків, яка визнається найбільш чистою.
Визначають карбонатную, некарбонатную і магниевую жорсткість. На підставі цих даних підраховують кількість вапна і соди, необхідне для усунення жорсткості.
Загальна жорсткість води (сумарна кількість іонів кальцію і магнію) може бути визначена комплексонометріческім методом - титрування розчином трилону Б в присутності металлоіндікаторов індикаторів хромогенів - синього або чорного в аміачної середовищі (рН 9 - 10). Цей метод заснований на тому, що іони кальцію і магнію зв'язуються трилоном Б в комплексні сполуки. При цьому протікає наступна реакція (на прикладі Са 2+):
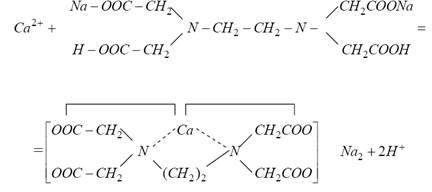
Метал заміщає іони водню карбоксильних груп і зв'язується одночасно координаційної зв'язком з атомами азоту. Незалежно від заряду катіона в реакції комплексоутворення бере участь один аніон ЕДТА і один катіон металу, при цьому відбувається виділення двох іонів водню. Про кінець реакції судять по зміні кольору металлоіндікатора [1] еріохромового чорного Т від вино-червоного до сірувато-синього. Поява сірувато-синього забарвлення свідчить про відсутність іонів Са 2+ і Mg 2+ в розчині, тобто про повне зв'язуванні їх трилоном Б.