з цим валентний електрон зовнішнього шару атомів лужних металів легко відривається, перетворюючи їх в позитивні однозарядного іони. Цим обумовлено те. що з'єднання лужних металів з іншими елементами побудовані за типом іонної зв'язку.
В окисно-відновних реакціях лужні метали поводяться як сильні відновники, і ця здатність зростає від металу до металу зі збільшенням заряду ядра атома.
Серед металів лужні метали проявляють найбільш високу хімічну активність. В ряді напруг все лужні метали розташовуються на початку ряду. Електрон зовнішнього електронного шару є єдиним валентним електроном, тому лужні метали в будь-яких з'єднаннях одновалентних. Ступінь окислення лужних металів зазвичай +1.
Фізичні властивості лужних металів наведені в табл. 19.
Фізичні властивості лужних металів. Таблиця 19
Температура плавлення, ° С
Температура кипіння, ° С
Твердість за шкалою
Типовими представниками лужних металів є натрій і калій.
■ 26. Складіть загальну характеристику лужних металів за таким планом:
а) подібність і відмінність в будові атомів лужних металів;
б) особливості поведінки лужних металів в окисно-відновних реакціях;
в) тип кристалічної решітки в з'єднаннях лужних металів;
г) особливості зміни фізичних властивостей металів в залежності від радіуса атома. (Див. Відповідь)
§ 97. Натрій
Електронна конфігурація атома натрію ls 2 2s 2 2p 6 3s 1. Структура його зовнішнього шару:
Натрій зустрічається в природі тільки у вигляді солей. Найбільш поширеною сіллю натрію є куховарська сіль NaCl, а також мінерал сильвинит КCl · NaCl і деякі сірчанокислий солі, наприклад глауберової сіль Na2SO4 · 10H2O, яка трапляється у великих кількостях в затоці Каспійського моря Кара-Богаз-Гол.
З кухонної солі NaCl металевий натрій отримують шляхом електролізу розплаву цієї солі. Установка для електролізу зображена на рис. 76. У розплавлену сіль опускають електроди. Анодна і катодного простір поділений діафрагмою, яка ізолює утворюється хлор від натрію, щоб не сталося зворотної реакції. Позитивний іон натрію приймає з катода електрон і перетворюється в нейтральний атом натрію. Нейтральні атоми натрію збираються на катоді у вигляді розплавленого металу. Відбувається на катоді процес можна зобразити наступною схемою:
Na + + Na 0.
Оскільки на катоді відбувається прийняття електронів, а будь-яке прийняття електронів атомом або іоном є відновленням, то іони натрію на катоді відновлюються. На аноді іони хлору віддають електрони, т. Е. Відбувається процес окислення і виділення вільного
газоподібного хлору, що можна зобразити наступною схемою:
Cl - - е - → Cl 0
Отриманий металевий натрій має сріблясто-білий колір, легко ріжеться ножем. Зріз у натрію, якщо його розглянути відразу після розрізу, має яскравий металевий блиск, але швидко тьмяніє внаслідок вкрай швидкого окислення металу.
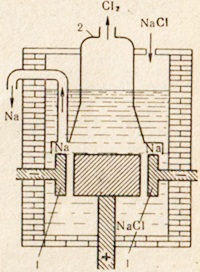
Мал. 76. Схема установки для електролізу розплаву куховарської солі.
1 - кільцевої катод; 2 - дзвін для виведення газоподібного хлору з анодного простору
Якщо натрій окисляти в невеликій кількості кисню при температурі близько 180 °, то виходить окис натрію:
4Na + О2 = 2Na2O.
При горінні в кисні виходить перекис натрію:
2Na + O2 = Na2O2.
При цьому натрій згорає сліпуче жовтим полум'ям.
У зв'язку з легкої і швидкої окислюваність натрію його зберігають під шаром гасу або парафіну, причому парафін краще, так як в гасі все ж розчиняється певна кількість повітря і окислення натрію хоча і повільно, але все ж відбувається.
Натрій може давати з'єднання з воднем - гідрид NaH, в якому водень виявляє ступінь окислення - 1. Це солеподібний з'єднання, яке за характером хімічного зв'язку і величиною ступеня окислення відрізняється від летючих гідридів елементів головних підгруп IV-VII групи.
Металевий натрій може реагувати не тільки з киснем і воднем, а й з багатьма простими і складними речовинами. Наприклад, при розтиранні в ступці з сірої натрій бурхливо реагує з нею, утворюючи сульфід натрію:
2Na + S = Na2S
Реакція супроводжується спалахами, тому ступку потрібно тримати подалі від очей і обернути руку рушником. Для реакції слід брати невеликі шматочки натрію.
Натрій енергійно згорає в хлорі з утворенням хлориду натрію, що особливо добре спостерігати в хлор-кальцієвої трубці, в якій через розплавлений і сильно розігрітий натрій пропускають струм хлору:
2Na + Сl2 = 2NaCl
Натрій реагує не тільки з простими, а й зі складними речовинами, наприклад з водою, витісняючи з неї водень. так як є дуже активним металом, в ряді напруг коштує набагато лівіше водню і легко витісняє останній з води:
2Na + 2Н2O = 2NaOH + H2
Який загорівся лужної метал не можна гасити водою. Найкраще засипати його порошком кальцинованої соди. У присутності натрію безбарвне полум'я газового пальника забарвлюється в жовтий колір.
Металевий натрій можна використовувати як каталізатор в органічному синтезі, наприклад при виробництві синтетичного каучуку з бутадієну. Він служить вихідною речовиною для отримання інших сполук натрію, наприклад перекису натрію.
■ 27. Доведіть за допомогою наведених в тексті рівнянь реакцій за участю металевого натрію, що він веде себе як відновник. (Див. Відповідь)
28. Чому натрій не можна зберігати на повітрі?
29. Учень опустив в розчин сульфату міді шматочок натрію, сподіваючись витіснити з солі металеву мідь. Замість металу червоного кольору вийшов драглистий блакитний осад. Опишіть відбулися реакції і напишіть їх рівняння в молекулярній і іонній формах. Як слід було змінити умови реакції, щоб реакція привела до бажаного результату? Рівняння напишіть в молекулярної, повної та скороченої іонної формах.
30. У посудину з 45 мл води помістили 2,3 г металевого натрію. Яка концентрація розчину їдкого натру, що утворився після закінчення реакції.
31. Які засоби можна застосовувати при гасінні загорівся натрію? Дайте обґрунтовану відповідь. (Див. Відповідь)
§ 98. Кисневі сполуки натрію. Їдкий натр
Кисневими сполуками натрію, як уже було сказано, є окис натрію Na2O і перекис натрію Na2O2.
Окис натрію Na2O особливого значення не має. Вона енергійно реагує з водою, утворюючи їдкий натр:
Na2O + Н2O = 2NaOH
Перекис натрію Na202 - жовтуватий порошок. Її можна розглядати як своєрідну сіль перекису водню, бо структура її така ж, як у Н2O2. Як і перекис водню. перекис натрію є найсильнішим окислювачем. При дії води вона утворює луг і перекис водню:
Na2O2 + Н2O = Н2O2 + 2NaOH
Перекис водню утворюється і при дії розбавлених кислот на перекис натрію:
Na2O2 + H2SO4 = Н2O2 + Na2SO4
Всі зазначені вище властивості перекису натрію дозволяють використовувати її для відбілювання все можливих матеріалів.
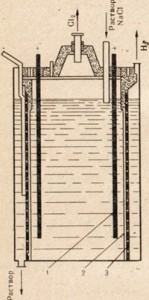
Мал. 77. Схема установки для електролізу розчину кухонної солі.
1 - анод; 2 - діафрагма, що розділяє анодна і катодного простір; 3 -катод
Дуже важливим з'єднанням натрію є гідроокис натрію, або їдкий натр, NaOH. Його називають також каустичною содою, або просто каустиком.
Для отримання їдкого натру використовують кухонну сіль - найбільш дешеве природне з'єднання натрію, піддаючи її електролізу, але в цьому випадку застосовують не розплав, а розчин солі (рис. 77). Опис процесу електролізу розчину кухонної солі см. § 33. На рис. 77 показано, що анодна і катодного простір поділений діафрагмою. Це зроблено з тією метою, щоб утворюються продукти не вступали між собою у взаємодію, наприклад Сl2 + 2NaOH = NaClO + NaCl + Н2О.
Їдкий натр - тверда кристалічна речовина білого кольору, прекрасно розчинний у воді. При розчиненні їдкого натру у воді виділяється велика кількість тепла і розчин сильно розігрівається. Їдкий натр необхідно зберігати в добре закупорених судинах, щоб оберегти його від проникнення водяної пари, під дією яких він може сильно зволожити, а також двоокису вуглецю, під дією якої їдкий натр може поступово перетворитися в карбонат натрію:
2NaOH + СO2 = Na2CO3 + Н2О.
Їдкий натр-типова луг, тому запобіжні заходи при роботі з ним такі ж, як і при роботі з будь-якими іншими лугами.
Їдкий натр застосовується в багатьох галузях промисловості, наприклад для очищення нафтопродуктів, виробництва мила з жирів, в паперовій промисловості, у виробництві штучного волокна і барвників, виробництві медикаментів та ін. (Рис. 78).
• Запишіть в зошит області застосування їдкого натру.
З солей натрію слід відзначити в першу чергу кухонну сіль NaCl, яка служить основною сировиною для отримання їдкого натру і металевого натрію (детально про цю солі см. Стр. 164), соду Na2CO3 (див. Стор. 278), сульфат натрію Na2SO4 (див . стор. 224), нітрат натрію NaNO3 (див. стор. 250) та ін.
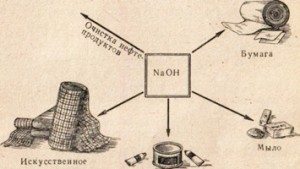
Мал. 78. Застосування їдкого натру
■ 32. Опишіть спосіб отримання їдкого натру електролізом повареної солі. (Див. Відповідь)
33. Їдкий натр можна отримати дією на карбонат натрію гашеним вапном. Складіть молекулярну і іонні форми рівняння цієї реакції, а також розрахуйте, скільки соди, що містить 95% карбонату, буде потрібно для отримання 40 кг їдкого натру.
34. Чому при зберіганні розчину їдкого натру в склянках з притертими пробками пробки «заїдають» і їх не можна вийняти? Якщо ж протягом деякого терміну потримати склянку перекинутої в воду, то пробка вільно виймається. Поясніть, привівши рівняння реакцій, що за процеси мають місце в даному випадку.
35. Напишіть рівняння реакцій в молекулярній та іонних формах, що характеризують властивості їдкого натру як типовою лугу.
36. Які запобіжні заходи слід дотримуватися при роботі з їдким натром? Які заходи першої допомоги слід надати при опіках їдким натром? (Див. Відповідь)
§ 99. Калій
Калій К - також досить поширений лужний метал, що відрізняється від натрію величиною атомного радіусу (четвертий період) і тому володіє більшою хімічною активністю, ніж натрій. Електронна конфігурація атома калію 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1.
Структура його зовнішнього електронного шару
Калій - м'який метал, який добре ріжеться ножем. Щоб уникнути окислення його, як і натрій, зберігають під шаром гасу.
З водою калій реагує ще більш бурхливо, ніж натрій, з утворенням лугу і з виділенням водню, який загоряється:
2К + 2Н2O = 2КОН + Н2.
При спалюванні в кисні (при цьому для спалювання рекомендується брати ще більш дрібні шматочки металу, ніж для спалювання натрію) він, подібно натрію, згоряє дуже енергійно з утворенням перекису калію.
Слід зазначити, що в зверненні калій набагато небезпечніше натрію. Сильний вибух може статися навіть при розрізанні калію, тому поводитися з ним треба ще обережніше.
Гідроокис калію, або їдке калі КОН - біла кристалічна речовина. Їдке калі у всіх відносинах схоже з їдким натром. Вони широко застосовуються в миловарінні, але його отримання обходиться трохи дорожче, тому такого застосування, як NaOH, воно не знаходить.
Солі калію слід відзначити особливо, тому що деякі з них широко використовуються в якості добрива. Такі хлорид калію КСl, нітрат калію KNO3, який є також азотним добривом.
■ 37. Чим пояснити те, що їдкий калій хімічно активніше їдкого натру? (Див. Відповідь)
38. У кристалізатор з водою опустили шматочок калію. Після того як реакція закінчилася, туди ж помістили трохи гідроксиду цинку у вигляді білого драглистого осаду. Осад зник, а при випробуванні розчину фенолфталеїном останній убрався в малиновий колір. Які хімічні процеси тут сталося?
Які речовини знаходяться в розчині? Дайте обґрунтовану відповідь.
39. Чому калій, як і всі лужні метали, відносять до сімейства s-елементів? (Див. Відповідь)