Підстави складаються з позитивно заряджених іонів металу і гідроксид-іонів ОН. Луги - це підстави, які добре розчиняються у воді.
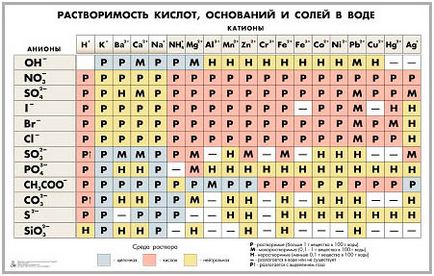
Відомості про розчинність в воді можна брати з таблиці розчинності. Р - розчинні підстави, тобто луги, м - малорозчинні, н - нерозчинні, риса «-» означає, що такої підстави не існує.
У звичайних умовах є твердими речовинами. Мають вигляд білих порошків, легко всмоктують вологу. Вимагають зберігання в банках з товстого скла з широкою шийкою або поліетиленових ємностях.
отримання підстав
Луг утворюється в результаті реакції металу і води з великим виділенням теплоти.
2Na + 2H2O> 2NaOH + H2
CaO + H2O> Ca (OH) 2.
Гідроксиди натрію і калію утворюються при впливі на розчин електричного струму:
KCl + 2H2O> 2KOH + H2 + Cl2.
властивості підстав
луги реагують
1. З кислотними оксидами:
2КОН + SO3> K2SO4 + H2O.
Луги здатні розчиняти оксидну плівку алюмінію (амфотерного оксиду):
2. З кислотами:
NaOH + HCl> NaCl + HOH.
Можна визначити, чи залишилася луг, якщо додати 1-2 краплі розчину фенолфталеїну. Луг прореагувала повністю, якщо малиновий колір забарвлення розчину не з'явився.
Реакція між підставою і кислотою - реакція нейтралізації. Подібні реакції часто застосовують з метою очищення стічних вод промислових підприємств від лугів і кислот. Продукти таких реакцій - солі, які більш безпечні для навколишнього середовища. Дуже ефективною і економічно вигідною є нейтралізація стоків різних виробництв.
3. З солями. Це реакції обміну. Відбуваються в розчині, при цьому вихідна сіль повинна бути водорастворимой. А що отримується речовина - нерозчинним:
2NaOH + Mn (NO3) 2 = Mn (OH) 2v + 2NaNO3
4. З галогенами.
На холоді: Cl2 + 2NaOH = NaClO + NaCl + H2O.
При нагріванні: 3Cl2 + 6NaOH = NaClO3 + 5NaCl + 3H2O.
Розплавити можна тільки гідроксиди натрію і калію (температури плавлення сполук складають 322о і 405о відповідно).
Безпека в роботі з лугами
Хімічні опіки, заподіяні лугами, в тому числі їдким натром і їдким калі, набагато небезпечніше, ніж хімічні опіки від кислот. Опік посилюється, якщо шматочок кристалічної речовини прилипає до шкіри.
Луги здатні роз'їдати багато матеріалів, викликати серйозні опіки на шкірі і слизових оболонках, вражати очі. Тому гідроксид натрію називають «їдким натром», а гідроксид калію - «їдким калі». При роботі з лугами і їх розчинами, потрібно дотримуватися обережності. При попаданні розчину лугу на шкіру, потрібно відразу змити його великою кількістю води. Потім обробити це місце слабким розчином оцтової або борної кислоти. І знову промити водою.
Що за речовина «нашатирний спирт»?
Рідина з назвою «нашатирний спирт» - це водний розчин газу аміаку NH3. Його використовують, як лікарський препарат. У нашатирному спирті містяться підставу NH4OH (гідроксид амонію). Утворюється в результаті реакції:
NH3 + H2O- NH4OH.
У взаємодію вступає невелика кількість розчиненого аміаку і одночасно розпадається на вихідні речовини, на що вказує знак «-» в рівнянні. Гідроксид амонію, подібно лугів, змінює забарвлення індикатора, взаємодіє з кислотними оксидами, кислотами та солями.
2NH4OH + СО2> (NH4) 2СО3 + H2O
NH4OH + HCl> NH4Cl + H2O
NH4OH + Pb (NO3) 2> Pb (OH) 2v + 2NH4NO3.
застосування підстав

Нашатирний спирт використовують не тільки для того, щоб привести людину до тями. З його допомогою можна відмінно вимити вікна, використовуючи 1 столову ложку препарату на 1 літр води. Потім потрібно витерти поверхню паперовими рушниками.
Якщо змішати 1 частину нашатирного спирту з 1 частиною оцту, а потім протирати отриманим розчином поверхню праски, то він стане чистим. Але не варто думати, що вийде миттєвий ефект. Поверхня потрібно акуратно потерти.
Широко застосовують, перш за все, гідроксиди кальцію і натрію. Гашене вапно - це гідроксид кальцію Са (OH) 2. Її використовують, як в'яжучий матеріал в будівництві. Змішують з піском і водою. Отриману суміш наносять на цеглу, штукатурять стіни. В результаті взаємодії підстави з вуглекислим газом і оксидом силіциуму (IV), суміш твердне. Вапно здатна поглинати кислі гази. Також може вбирати токсичні речовини, тому для здоров'я мешканців білити кімнату краще, ніж фарбувати.
Також гідроксид кальцію використовують у цукровій промисловості, сільському господарстві, при виготовленні зубних паст, отриманні багатьох речовин.
Гідроксид натрію (каустичну соду) використовують при виробництві мила в реакції лугу з жиром, при виготовленні ліків, в шкіряної промисловості, для очищення нафти. Каустична сода застосовується для чищення масляних плям. Всім відомий «Кріт» для труб являє собою розчин гідроксиду натрію, здатний розчиняти жири і навіть волосся.

Луги роз'їдають скло і фарфор. Розчиняють білкові речовини.
Застосовуються в медицині як антисептики, дратівливих і припікальних препаратів. При захворюваннях травної системи лужні мінеральні води діють оздоравлівающе. Ефективні в лікуванні подагри, стоматиту, в лікуванні захворювань дихальної системи. Є сечогінним засобом. Нейтралізують отруєння кислотами.
Важливо участь лугів у виготовленні каучуку, штучного волокна, барвників, очищення предметів з металу, обробки дерев'яних поверхонь. Є холодоагентом холодильних установок. Використовуються в сільському господарстві, легкій промисловості та металургії.
Лужні продукти харчування
Розрізняють кислі, лужні і нейтральні продукти харчування. Серед лужних продуктів можна перерахувати зелень, ріпу, огірки, хрін, селера, лимони, буряк, моркву, капусту, цитрусові, смородину, виноград, вишню, сухофрукти, картопля, перець, помідори, часник.

Примітно, що в складі нейтральних продуктів містяться і кислоти, і лугу. Це рослинне, вершкове масло.
Цікаво, що молоко - це лужний продукт. Але тепле або кип'ячене молоко - кислий продукт.
Луги активно використовуються людиною. При цьому слід пам'ятати і в обов'язковому порядку дотримуватися правил техніки безпеки.