Підготовка до сприйняття нового матеріалу.
- Які основні положення молекулярної теорії будови речовини?
- Яка існує зв'язок між швидкістю руху молекул і температурою тіла?
- Який енергією володіють молекули внаслідок свого руху? Внаслідок взаємодії?
- Яку енергію називають внутрішньою?
- Якими способами можна змінити внутрішню енергію?
- У яких агрегатних станах може перебувати речовина?
- Чи може речовина одночасно перебувати в трьох агрегатних станах?
- Чи змінюються молекули при переході речовини з одного стану в інший?
Рідина це агрегатний стан речовини, проміжне між газоподібним і твердим.
Це агрегатний стан речовини, в якому молекули (або атоми) пов'язані між собою настільки, що це дозволяє йому зберігати свій обсяг, але недостатньо сильно, щоб зберігати і форму.
Рідини внаслідок різного характеру руху молекул суттєво відрізняються від газів і твердих тіл.
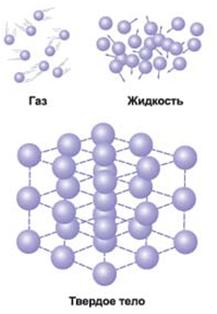
Молекули речовини в рідкому стані розташовані майже впритул один до одного. На відміну від твердих кристалічних тіл, в яких молекули утворюють впорядковані структури у всьому об'ємі кристала і можуть здійснювати теплові коливання близько фіксованих центрів, молекули рідини мають більшу свободу. Кожна молекула рідини, також як і в твердому тілі, «затиснута» з усіх боків сусідніми молекулами і робить теплові коливання близько деякого положення рівноваги. Однак, час від часу будь-яка молекула може переміститися в сусіднє вакантне місце. Такі переходи в рідинах відбуваються досить часто; тому молекули не прив'язані до певних центрам, як в кристалах, і можуть переміщатися по всьому об'єму рідини. Цим пояснюється плинність рідин. Рідина завжди набуває форми того посудини, в якому вона знаходиться.
Плинність рідини пояснюється «стрибками» молекул з одного осілого положення в інше в усіх напрямках з однаковою частотою.
Через сильний взаємодії між близько розташованими молекулами вони можуть утворювати локальні (нестійкі) впорядковані групи, що містять кілька молекул. Це явище називається ближнім порядком:
Приклад ближнього порядку молекул рідини і далекого порядку молекул кристалічної речовини: 1 - вода; 2 - лід.
У рідини існує ближній порядок в розташуванні молекул і відсутній дальній порядок.
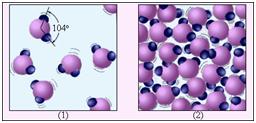
Нижче розташований малюнок ілюструє відміну газоподібної речовини від рідини на прикладі води. Молекула води H2 O складається з одного атома кисню і двох атомів водню, розташованих під кутом 104 °. Середня відстань між молекулами пара в десятки разів перевищує середню відстань між молекулами води.
Внаслідок щільної упаковки молекул стисливість рідин, тобто зміна обсягу при зміні тиску, дуже мала; вона в десятки і сотні тисяч разів менше, ніж в газах.
Рідина практично нестислива.
Теплове розширення рідин.
Рідини, як і тверді тіла, змінюють свій об'єм при зміні температури. При нагріванні рідини зростає середня кінетична енергія хаотичного руху її молекул. Це призводить до збільшення відстані між молекулами, а отже, і до збільшення обсягу. Теплове розширення рідин характеризується температурним коефіцієнтом об'ємного розширення.
Для не дуже великих інтервалів температур відносне зміна обсягу ΔV / V0 пропорційно зміні температури ΔT:
Коефіцієнт β називають температурним коефіцієнтом об'ємного розширення.
Цей коефіцієнт у рідин в десятки разів більше, ніж у твердих тіл.
У води при температурі 20 ° С βв ≈ 2 · 10 -4 К -1. у сталі β ст ≈ 3,6 · 10 -5 К -1. у кварцового скла β кв ≈ 9 · 10 -6 К -1.
При збільшенні обсягу тел зменшується їх щільність. Позначаючи через ρ і ρ0 щільності при температурах Т і Т0 відповідно і з огляду на, що ρ = m / V отримуємо ρ = ρ0 / (1+ β Т)