Лабораторні способи отримання підстав.
Бібліотека / Підстави / Бібліотека / Підстави / Лабораторні способи отримання підстав. Лабораторні способи отримання підстав.
У лабораторних умовах підстави отримують в невеликих кількостях, не більше ніж сто - двісті грам. Іноді більше, в залежності від потреби конкретної лабораторії в речовині. Але ці кількості незначні. У великих кількостях підстави в хіміко-технологічних лабораторіях можуть добувати лише в тих випадках, коли відпрацьовують методику отримання цієї речовини для промисловості.
Розглянемо основні способи отримання гидроокисей в лабораторії.
У лабораторії для отримання гидроокисей лужних металів застосовують два способи. Перший і найбільш дорогий, це пряме взаємодія лужних металів з водою, в результаті якого виходять лугу. Цей метод можна використовувати для отримання NaOH, KOH, LiOH, Ca (OH) 2.
Ці реакції досить небезпечні через використання активних металів: натрію, калію, літію. Не можна використовувати в цих реакціях велику кількість лужних металів, вони можуть спалахнути і навіть вибухнути.
У лабораторних умовах знайшли своє застосування і спрощені промислові способи отримання гідроксиду натрію. Чому саме гідроксиду натрію. тому що він найбільш широко використовується з усіх гідроксидів в хімії і промисловості. Для його отримання використовують електролізний метод. Схема проточної електролізної установки наведена на малюнку 2.
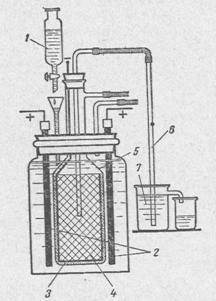
2 - аноди з графи-ту;
3 - діафрагма з азбестового картону;
4 - катод у вигляді циліндра з дном з залізного чи сталевого сітки;
5 - скляний дзвін;
6 - сифон для витіснення розчину з катодного простору;
7 - стакан для прийому лугу.
Кінці графітових анодів, що виступають над розчином, необхідно попередньо просочити розплавленим парафіном, щоб електроліт не піднімалося по капілярах і не руйнував контакт з міддю. Контакт мідного дроту з графітовим анодом здійснюють за допомогою мідного ковпачка, щільно одягненого на анод, або тугий намоткой зачищеного мідного дроту на кінець електрода. Катодом служить залізна або сталева сітка. Вона повинна своєю верхньою частиною щільно входити в скляний дзвін так, щоб водень не попадав в анодное простір. Азбест, попередньо змочений водою, з добавкою дуже невеликої кількості силікатного клею наносять у вигляді кашки на зовнішню сторону залізної сітки (товщина шару 5 - 10мм). Після того як азбест висохне, його можна злегка прожарити для того, щоб діафрагма залишалася міцною і в електроліті. Необхідна швидкість подачі і перетікання електроліту досягається за допомогою ділильної лійки з краном, як показано на малюнку 1.
Хлор і водень можна використовувати для отримання синтетичної соляної кислоти. З цією метою їх подають в пальник, що представляє собою скляний трійник, заповнений силікагелем.
Що випливає з електролізера розчин випарюють в порцелянової чашці. Час від часу зливаючи з осаду кухонної солі рідку частину, до кінця випарювання температуру доводять до 500 ° С. Потім розплав лугу охолоджують, подрібнюють і зберігають в закритому скляному посуді. Абсолютно чисту луг отримують охолодженням 35-процентного розчину технічного їдкого натру до 5 ° С. При цьому випадають кристали NaОН × 2Н2О і NaOH × 4Н2О, які відокремлюють від розчину і прожарюють.
За допомогою цієї ж установки можна отримувати і гідроксид калію і гідроксид літію. При отриманні лугів на даній установці потрібно дотримуватися особливих застережних обережності, адже одним з продуктів електролізу буде хлор.
Для отримання гідроксиду натрію іноді ще застосовують більш старий метод - кип'ятіння розчину соди з гашеним вапном:
Після закінчення реакції розчин зливають з осаду карбонату кальцію і, випарити воду, сплавляють отриманий гідроксид натрію.
Досить часто для проведення хімічних реакцій в лабораторіях потрібно отримувати нерозчинні в воді гідроксиди, такі як гідроксиди міді, цинку, кобальту, кадмію, нікелю. Для їх отримання застосовують реакцію взаємодії розчинних солей цих металів з гідроксидом натрію. За характером взаємодії ця реакція відноситься до реакцій обміну.
Гідроксид міді (синього кольору) і гідроксид нікелю (зелено - синього кольору) випадуть в осад. Після фільтрування розчину і промивання осаду, його можна використовувати в хімічних процесах. Таким чином, отримують гідроксиди міді (ІІ), цинку, кобальту, кадмію, ртуті (ІІ), олова, свинцю, марганцю, титану, хрому і багатьох інших металів.
Дивіться також
Полимераналогичние перетворення бутадієн бутадієну каучуків
Під реакціями полімерів розуміють всі хімічні перетворення заздалегідь утворилися макромолекул. Ці реакції можуть протікати зі збереженням, збільшенням або зменшенням ступеня полімеризації.
Сучасні тенденції та нові напрями в науці про полімери
Сучасні тенденції та нові напрями в науці про полімери яскраво проілюстровані в рамках досліджень проведених українським Фондом Фундаментальних Досліджень (РФФД) В даний ст.