Відносна кислотність спиртів зменшується в наступному порядку [c.49]
Каталізаторами реакції служать лугу, алкоголяти лужних металів. третинні аміни. За відсутності каталізаторів реакція з гликолями протікає дуже повільно і її швидкість збільшується з підвищенням кислотності спирту (особливо при заміні гликолей двохатомними фенолами). Лінійні олігомери мають ступінь полімеризації не більше 5-6. Великий надлишок діепоксідного з'єднання викликає переважне освіту кінцевих епоксидних груп. При нагріванні олігомерів з гликолями або з двохатомними фенолами відбувається нарощування молекулярно та освіту сітчастого полімеру. [C.80]
Кислотність фенолів значно вище, ніж кислотність спиртів, тому що утворюється фенолят-ио-н істотно стабілізовано внаслідок делокалізації заряду по ароматичного кільця [c.151]
В реакції оксіпропілірованія октадеканола реакційна, здатність ефірів нижче і становить лише 0,37-0,52 від реакційної активності спирту [92]. Мабуть, знайдені коефіцієнти справедливі тільки для досить вузької області концентрацій каталізатора. Прп кислотності спиртів, рівній кислотності води, реакційна здатність різних аніонів і гідроксил-іона відносяться між собою як [89] [c.314]
Кислотність спиртів у водному розчині [c.860]
Всі кошти консервації повинні задовольняти вимогу відповідних Держстандартів, ТУ і видаватися на ділянку в закритій тарі в кількості, необхідній для роботи однієї зміни. Перед початком роботи засоби консервації в обов'язковому порядку піддаються контролю в ЦЗЛ. Мастило перевіряється на відсутність вологи, механічних домішок, реакцію водної витяжки. парафінування. папір - на відсутність кислотності, спирт - на фортецю. Не допускається застосування спирту нижче 95%. [C.99]
Властивості фенолів істотно відрізняються від властивостей аліфатичних і ароматичних спиртів пояснення цьому дає теорія резонансу. Найважливіше відмінність полягає в тому, що вони мають не однакову кислотність спирти (у водному розчині) мають константу кислотності. приблизно рівну И0. тоді як феноли характеризуються приблизно в мільйон разів вищою кислотністю - їх константа кислотності дорівнює приблизно [c.364]
З огляду на можливість наявності в спирті наведених домішок, ГФ X висуває певні вимоги до чистоти етилового спирту. застосовується для медичних цілей. Так, нормується межа кислотності спирту, пропонується проводити реакції виявлення альдегідів з аміачним розчином нітрату срібла. відновлюють речовин - з розчином перманганату калію. який не повинен знебарвлюватися протягом 20 хв. [C.170]
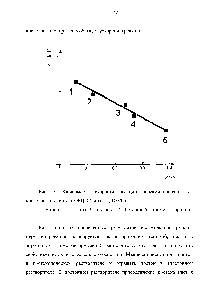
Для спиртів спостерігалася задовільна кореляція між швидкістю реакції та кислотністю спирту. Як видно з рис. 3 зростання [c.11]
КИСЛОТНОСТІ спирту сприяє прискоренню реакції. [C.12]
У разі фторованих ацильних груп летючість речовини особливо підвищується. Кислотність тиолов вище, ніж кислотність спиртів тому їх ацильні похідні утворюються насилу. При ацилированием первинних амінів зазвичай вдається [c.173]
Про кислотності спиртів свідчать їх реакції з активними металами. в результаті яких виділяється водень, а також їх здатність витісняти слабокислі вуглеводні з їх солей (наприклад, з реактивів Гриньяра) [c.507]
Кислотність спиртів СН ОН> первинний> вторинний> третинний [c.508]
М. В. Ломоносов писав в 1745 р При розчиненні будь-якого недорогоцінного металу. особливо заліза, в кислотних спиртах з отвору склянки виривається горючий пар, який являє собою не що інше, як флогистон. Термін флогистон в перекладі з грецького означав займистий. горючий. Переведіть слова Ломоносова на сучасну мову. [C.171]
Ломоносов писав про отримання водню. який він називав пальним паром. або флогистоном. При дії кислот (кислотних спиртів) на залізо йшла реакція [c.183]
В. Ломоносов тим часом не міг ігнорувати керівного% той час вчення про флогістон просто тому, що не існувало фактичних експериментальних даних, на основі кото яких було б можливо замінити теорію флогістону раціональної теорією горіння. Природно тому, що в працях М. В. Ломоносова зустрічаються посилання на теорію флогістону. Але він брав флогистон не в якості невагомого флюїду або якогось тонкого газу з негативною масою, а як матеріальне тіло. У дисертації Про металевому блиску (1745) М. В. Ломоносов висловив думку, що флогістон - це не що інше, як водень. При розчиненні, - писав він, - будь-якого недорогоцінного металу. особливо заліза, в кислотних спиртах з отвору склянки виривається горючий пар, який являє собою не що інше, як флогистон (курсив мій. - [c.47]
О-Н-зв'язок реакції з розривом О-Н-зв'язку визначають кислотність спирту [c.17]
У табл. 16.3 наведені дані, що ілюструють залежність кислотності спиртів від їх будови. Там же представлені дані про силу деяких мінеральних кислот. Ці дані цікаві для порівняння, оскільки, як буде показано далі, багато реакції спиртів катализируются мінеральними кислотами. [C.17]
Визначення відносної сили кислот. таке необхідне для пояснення кислотно-основних взаємодій. є непростим завданням, так як результат кількісних вимірювань залежить від середовища, в якій вони здійснюються Зміна середовища призводить не тільки до змін констант кислотності. але і до зміни ряду відносної кислотності для конкретної серії кислот Наприклад, ряди кислотності спиртів в різних середовищах різні [c.494]
Всі кислоти, або як їх називає Ломоносов, кислотні спирти або кислі солі. забарвлюють фіалковий сироп в червоний колір, подібні за роз'їдає здатності і кислого смаку, але розрізняються різною силою. Безсумнівно, що роз'їдання і кислотність походять від одного і того ж початку. [C.21]
Різниця в кислотності спиртів н фенолів наочно проявляється в тому, що спирти заміщають свій гідроксильний водень лшіь по.д дією лужних металів (освіта алкоголятов) [c.283]
У 1745 р М. В. Ломоносов, наприклад, зазначав, що при розчиненні будь-якого недорогоцінного металу. особливо заліза, в кислотних спиртах з отвору склянки виривається горючий нар, який являє собою пе що інше, як флогистон Це примітно в двох відносинах по-перше, за багато років до Кавендіша М. В. Ломоносов нрішел до висновку, що горючий повітря (т . е. водень) являє собою флогистон по-друге, з наведеної цитати випливає, що М. В. Ломоносов брав вчення про флогістон. [C.69]
Кислотність спиртів недостатня для того, щоб утворити з діазометаном метилові ефіри. Якщо, проте, додати каталітичні кількості борофторістоводородной кислоти або перевести спирти в ансольвокіслоти. то можна здійснити їх метилювання діазометаном [c.249]
Результати, отримані в газовій фазі. показьшают, що звернення ряду кислотності спиртів у воді (а також "неправильне" положення води в ряду кислотності між метанолом і етанолом) пов'язано виключно з сольватацией, сила якої перевершує силу взаімодейсгвія "іон-іідуціроваііьгй дгшоль" [c.269]
Як відрізняються спирти по своїй кислотності Встановлено, що третинні спирти мають найбільш низьку кислотність. Знижена кислотність mpem-бутилового спирту в порівнянні з етиловим зумовлена просторовими труднощами. створюваними алкильной групою. для сольватации алкокси-аніону. Зменшення сольватации позначається на зростанні енергії аниона, збільшенні акт для відриву протона і збільшення різниці енергій між спиртом і алкоголятов (рис. 1U-1). Слід зазначити, що порядок кислотності спиртів в паровій фазі. де сольватация несушей, ественной. є зворотним порядком кислотності в розчинах. [C.408]
Приєднання спиртів і фенолів, що каталізує трехфто Рісто бором. Спирти і феноли в більшості випадків (за винятком таких сполук, як пікринова кислота) мають недостатньо кислим характером для приєднання кетЬ-ксіацетілену за відсутності каталізатора. Кислотність спиртів і фенолів можна підвищити додаванням трехфтористого бору, іноді разом з окисом ртуті в цих умовах легко відбувається приєднання [3]. Однак каталізатор викликає полімеризацію етоксіацетілена. тому виходи продуктів приєднання досить низькі. [C.160]
На інтерпретацію впливу розчинників і заступників на кислотно-основну рівновагу великий вплив зробили роботи Браумана і Блера [34], які показали, що відносна кислотність аліфатичних спиртів при переході від розчинів до газової фазі змінюється на зворотну. У газовій фазі кислотність спиртів підвищується в наступному порядку [34, 125, 126] [c.136]
Виробництво титрування. Відважена кількість амінокіелоти илн солі останньої або суміші амінокіелот розчиняють у воді, вільній від СОГ, і доводять концентрацію до О.Ш по відношенню до карбоксильних груп. В окремих пробах цього розчину виробляють такі визначення а) титрування О.Ш їдким натром за допомогою фенолфталеїну в воді б) титрування в спирті. До певної кількості розчину додають 10-кратний обсяг 97% -ного спирту і титрують спиртовим б.Ш розчином КОН з поправкою на первісну кислотність спирту в) титрування в спиртовому розчині формаліну до розчину, відтитрувати за способом (б) додають на кожні 50 см спирту по 12,5 СЛГ суміші з однієї частини безбарвного формаліну і двох частин води, нейтралізованої за фенолфталеїном, і тітрукуг далі. Для поправки титрують одну суміш формаліну зі спиртом в тих же відносинах (нейтральний формалін дуже мало підвищує кислотність чистого спирту). [C.763]
Водень в гідроксильної групі аліфатичних спиртів і в аминогруппе амінів має занадто малу протонної рухливістю для того, щоб взаємодіяти з діазометаном. Однак, посиливши кислотність спирту, обробивши його кислотою Льюїса (ВРЗ, 2пС12-см. Розд. 3.1.3), можна отримати з [c.427]
Як видно з даних таблиці, розгалуженість алкильной групи знижує кислотність спиртів, а введення в їх молекули атомів галогенів. навпаки, підвищує її. [C.17]
Дивитися сторінки де згадується термін Кислотність спиртів. [C.538] [c.179] [c.348] [c.28] [c.137] [c.140] [c.427] [c.57] [c.17] Методи отримання і деякі прості реакції приєднання альдегідів і кетонів Ч.1 (0) - [c.408]
Введення в теоретичну органічну хімію (1974) - [c.240]