Однією з важливих рис хімічних реакцій, що протікають в живих організмах, є їх каталітична природа. Живу клітину можна представити як мініатюрний каталітичний реактор. Відмінність клітини від колби хіміка полягає в тому, що якщо в колбі все реакції протікають незалежно (здійснюється фундаментальний принцип незалежності реакцій), то в клітці все відбувається взаємопов'язане.
Це відбувається не тому, що порушуються фізичні закони або клітина підпорядковується іншим законам - немає, в живих матеріях діють одні закони. Просто в процесі еволюції природою був створений ефективний апарат регулювання всіх клітинних реакцій, який дозволяє всій клітці контролювати співвідношення продуктів таким чином, щоб оптимально функціонували всі реакції.
Таким чином, всі біохімічні реакції - це реакції каталітичні.
Біологічні каталізатори називаються ферментами або ензимами.
В принципі, в клітці протікають ті ж хімічні реакції, що і в хімічній лабораторії, але на умови протікання реакцій в клітці накладаються жорсткі обмеження, а саме T = 37 # 9702; З і P = 1 атм.
Тому часто процеси, які в лабораторії протікають в 1 стадію, в живих клітинах в здійснюються в кілька стадій.
Сутність каталітичних реакцій, незважаючи на різноманіття, зводиться до того, що вихідні речовини, утворюють з каталізатором проміжне з'єднання. яке відносно швидко перетворюється в продукти реакції, регенеруючи каталізатор.
Іноді проміжні сполуки можна виділити в чистому вигляді, але зазвичай вони складаються з нестійких молекул, які торік можливо тільки за допомогою дуже чутливих спектральних приладів.
Процес за участю каталізатора - циклічний або кругової.
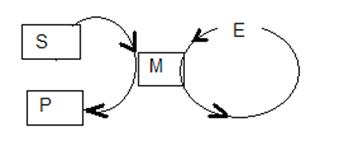
Міра активності ферменту - число оборотів (число молей субстрату, претерпевающих зміна за 1 хвилину в розрахунку на 1 моль ферменту)
Число оборотів може досягати 10 8.
Досить часто цикли роботи декількох каталізаторів з'єднуються разом, утворюючи круговий процес.
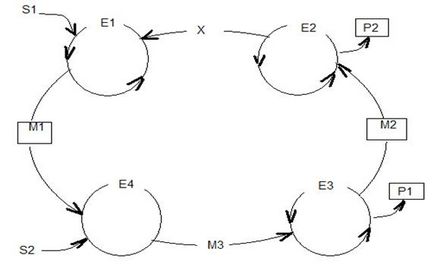
Речовини S1 і S2 перетворюються в продукти Р1 і Р2. В ході цього перетворення спочатку S1 реагує з третім речовиною Х і каталізатором Е1, утворюючи проміжний продукт М1, який в свою чергу за допомогою каталізатора Е2 перетворюється в проміжний продукт М2 і т. Д.
Прискорює дію каталізатора пов'язано зі зменшенням енергії активації (це та додаткова енергія, яка повинна бути повідомлена одному молю речовини, щоб частинки речовини стали реакційно здатними і могли подолати енергетичний бар'єр реакції).
До основних властивостей ферментів відносяться:
- ефективність, яка полягає в ступені прискорення (прискорення в 100 млн разів).
- підвищена Субстратна специфічність. Ферменти відрізняють субстрат завдяки біологічному пізнанню (комплементарності).
- підвищена специфічність каталізуються реакції. Більшість ферментів прискорює один тип реакцій.
- підвищена специфічність по відношенню до оптичних ізомерів (можуть дізнаватися ліві і праві ізомери).
Причина всіх унікальних властивостей ферментів - їх просторову будову. Зазвичай це глобулярні білки, набагато перевершують за розмірами субстрат. Ця обставина призводить до того, що в процесі еволюції на поверхні ферменту утворився активний центр, який комплементарний субстрату. Це замок і ключ.
Умовно активні центри діляться на: зв'язують і каталітичні.
Зв'язує центр пов'язує субстрат і оптимально орієнтує його по відношенню до катализируемой групі, в каталізує ж центрі зосереджені всі активні групи.
Якщо для проведення реакції необхідно провести гідроліз (білків, ліпідів), то що каталізує центр формується бічними радикалами АК - залишків.
В цьому випадку фермент складається тільки з поліпептидних ланцюгів. Однак крім гидролитических реакцій протікають і інші: окислювально-відновні, реакції перенесення будь-яких груп.
У цих випадках в ферментах міститься небілкова частина. Ця частина - кофермент (rофактор, простетичної група). Білкова частина забезпечує зв'язує дію, а кофермент - каталітичне. Білкова частина - апофермент.
Апофермент + кофермент ↔холофермент