Вода, будучи вельми слабким електролітом, в дуже малому ступені дисоціює на іони:
Даний рівноважний процес описується константою рівноваги:
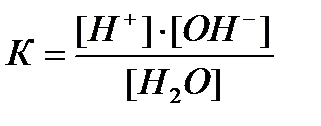
де К - константа дисоціації води. При 22 0 С вона дорівнює 1,8 # 8729; 10 -16.
Так як ступінь дисоціації води дуже мала, то в рівнянні (1) концентрацію води [Н2 О] можна вважати величиною постійною
,
де КW - іонний добуток води.
Підставляючи значення К і [Н2 О] в рівняння (2), отримаємо чисельне значення іонного добутку води при 22 0 С.
Kw = [H +] [OH -] = 1,8 # 8729; 10 -16 # 8729; 55,56 = 10 -14
Залежність КW від температури демонструється такими даними:
t, C 0 10 22 30 50 100
КW 0,36 × 10 -14 1,00 × 10 -14 1,89 × 10 -14 5,6 × 10 -14 74 × 10 -14
Таким чином, КW - величина постійна лише при даній температурі.
Розчини, в яких концентрації іонів водню і гідроксид-іонів однакові, називаються нейтральними розчинами. При 22 0 С в нейтральних розчинах концентрація як іонів водню, так і гідроксид-іонів дорівнює 10 -7 моль / л. У кислих розчинах більше концентрація іонів водню, в лужних - концентрація гідроксид-іонів. Але якою б не була реакція розчину, твір концентрацій іонів водню і гідроксид - іонів залишається постійним.
Звідси випливає, що ступінь кислотності і ступінь основності розчину можна виразити за допомогою концентрацій іонів H + або OH -:
Нейтральний розчин [H +] = 10 -7 моль / л,
Кислий розчин [H +]> 10 -7 моль / л,
Лужний розчин [H +] <10 -7 моль/л.
Щоб уникнути незручностей, пов'язаних із застосуванням чисел з негативними показниками ступеня, концентрацію водневих іонів прийнято виражати через водневий показник і позначати символом рН.
Водневим показником рН називають десятковий логарифм концентрації водневих іонів, узятий з оберненим знаком:
рH = -lg [H +] або [Н +] = 10 -рН
де [Н +] - концентрація іонів водню, моль / л.
Гідроксильних показником рОН називають десятковий логарифм концентрації гідроксид-іонів, узятий з оберненим знаком:
рОН = - lg [OH -] або [ОН -] = 10 -рОН
де [ОН -] - концентрація гідроксид-іонів, моль / л.
рН + рОН = 14; рОН = 14 - рН.
Наочно залежність між концентрацією іонів водню, величиною рН і реакцією розчину можна виразити схемою

Зі схеми видно, що чим менше рН, тим більше концентрація іонів Н +. тобто вища кислотність середовища; і навпаки, чим більше рН, тим менше концентрація іонів Н +. т. е. вище лужність середовища.