Іонна і металева зв'язок. Іонні і металеві кристали
Іонна зв'язок здійснюється шляхом електростатичного притягання між протилежно зарядженими іонами. Ці іони утворюються в результаті переходу електронів від одного атома до іншого. Іонна зв'язок утворюється між атомами, що мають великі відмінності електроотріцательностей (зазвичай більше 1,7 за шкалою Полінга), наприклад, між атомами лужних металів і галогенів.
Розглянемо виникнення іонної зв'язку на прикладі освіти NaCl.
З електронних формул атомів
Na 1s 2 2s 2 2p 6 3s 1 і
Cl 1s 2 2s 2 2p 6 3s 2 3p 5
видно, що для завершення зовнішнього рівня атому натрію легше віддати один електрон, ніж приєднати сім, а атому хлору легше приєднати один, ніж віддати сім. У хімічних реакціях атом натрію віддає один електрон, а атом хлору приймає його. В результаті електронні оболонки атомів натрію і хлору перетворюються в стійкі електронні оболонки інертних газів (електронна конфігурація катіона натрію
Na + 1s 2 2s 2 2p 6.
а електронна конфігурація аниона хлору
Cl - - 1s 2 2s 2 2p 6 3s 2 3p 6).
Електростатичне взаємодія іонів призводить до утворення молекули NaCl.
Характер хімічного зв'язку часто знаходить відображення в агрегатному стані і фізичні властивості речовини. Такі іонні сполуки, як хлорид натрію NaCl тверді і тугоплавкі тому, що між зарядами їх іонів "+" і "-" існують потужні сили електростатичного притягання.
Негативно заряджений іон хлору притягує не тільки "свій" іон Na +, а й інші іони натрію навколо себе. Це призводить до того, що близько будь-якого з іонів знаходиться не один іон з протилежним знаком, а кілька.
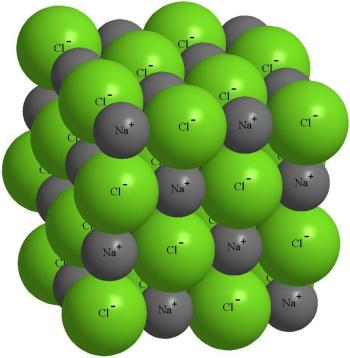
Будова кристала кухонної солі NaCl.
Фактично, у будь-якого іона хлору розташовується 6 іонів натрію, а біля кожного іона натрію - 6 іонів хлору. Така впорядкована упаковка іонів називається іонним кристалом. Якщо в кристалі виділити окремий атом хлору, то серед тих, що оточують його атомів натрію вже неможливо знайти той, з яким хлор вступав в реакцію.
Притягнуті один до одного електростатичними силами, іони вкрай неохоче змінюють своє місце розташування під впливом зовнішнього зусилля або підвищення температури. Але якщо хлорид натрію розплавити і продовжувати нагрівати у вакуумі, то він випаровується, утворюючи двоатомних молекули NaCl. Це говорить про те, що сили ковалентного зв'язування ніколи не вимикаються повністю.
Основні характеристики іонної зв'язку та властивості іонних з'єднань
1. Іонна зв'язок є міцною хімічним зв'язком. Енергія зв'язку з цим становить величини порядку 300 - 700 кДж / моль.
2. На відміну від ковалентного зв'язку, іонна зв'язок є ненаправленої, оскільки іон може притягувати до себе іони протилежного знаку в будь-якому напрямку.
3. На відміну від ковалентного зв'язку, іонна зв'язок є ненасиченим, так як взаємодія іонів протилежного знака не призводить до повної взаємної компенсації їх силових полів.
4. В процесі утворення молекул з іонним зв'язком не відбувається повної передачі електронів, тому стовідсоткової іонної зв'язку в природі не існує. У молекулі NaCl хімічний зв'язок лише на 80% іонна.
5. З'єднання з іонним зв'язком - це тверді кристалічні речовини, що мають високі температури плавлення і кипіння.
6. Більшість іонних з'єднань розчиняються у воді. Розчини й розплави іонних з'єднань проводять електричний струм.
По-іншому влаштовані металеві кристали. Якщо розглянути шматочок металевого натрію, то виявиться, що зовні він сильно відрізняється від кухонної солі. Натрій - м'який метал, легко ріжеться ножем, розплющується молотком, його можна без праці розплавити в чашечці на спиртівці (температура плавлення 97,8 ° С). У кристалі натрію кожен атом оточений вісьмома іншими такими ж атомами.
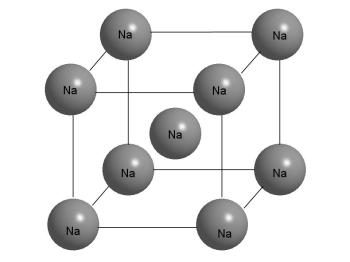
Будова кристала металевого Na.
З малюнка видно, що атом Na в центрі куба має 8 найближчих сусідів. Але це ж можна сказати і про будь-якому іншому атомі в кристалі, оскільки всі вони однакові. Кристал складається з "нескінченно" повторюваних фрагментів, зображених на цьому малюнку.
Атоми металів на зовнішньому енергетичному рівні містять невелику кількість валентних електронів. Оскільки енергія іонізації атомів металів невелика, валентні електрони слабо утримуються в цих атомах. В результаті в кристалічній решітці металів з'являються позитивно заряджені іони і вільні електрони. При цьому катіони металу перебувають у вузлах кристалічної решітки, а електрони вільно переміщаються в поле позитивних центрів утворюючи так званий «електронний газ».
Наявність між двома катіонами негативно зарядженого електрона приводить до того, що кожен катіон взаємодіє з цим електроном.
Таким чином, металева зв'язок - це зв'язок між позитивними іонами в кристалах металів, яка здійснюється шляхом тяжіння електронів, вільно переміщаються по всьому кристалу.
Оскільки валентні електрони в металі рівномірно розподілені по всьому кристалу металева зв'язок, як і іонна, є ненаправленої зв'язком. На відміну від ковалентного зв'язку, металевий зв'язок є ненасиченим зв'язком. Від ковалентного зв'язку металева зв'язок відрізняється також і міцністю. Енергія металевої зв'язку приблизно в три - чотири рази менше енергії ковалентного зв'язку.
Унаслідок великої рухливості електронного газу метали характеризуються високою електро- і теплопровідністю.
Металевий кристал виглядає досить простим, але насправді його електронний пристрій складніше, ніж у кристалів іонних солей. На зовнішній електронній оболонці елементів-металів недостатньо електронів для утворення повноцінної "октетное" ковалентного або іонного зв'язку. Тому в газоподібному стані більшість металів складається з одноатомних молекул, (тобто окремих, не пов'язаних між собою атомів). Типовий приклад - пари ртуті. Таким чином, металевий зв'язок між атомами металів виникає тільки в рідкому і твердому агрегатному стані.
Описати металеву зв'язок можна наступним чином: частина атомів металу в образующемся кристалі віддають в простір між атомами свої валентні електрони (у натрію це. 3s1), перетворюючись в іони. Оскільки всі атоми металу в кристалі однакові, кожен з них має рівні з іншими шанси втратити валентний електрон.
Іншими словами, перехід електронів між нейтральними і іонізованими атомами металу відбувається без витрат енергії. Частина електронів при цьому завжди виявляється в просторі між атомами у вигляді "електронного газу".
Ці вільні електрони, по-перше, утримують атоми металу на певному рівноважному відстані один від одного.
По-друге, вони надають металам характерний "металевий блиск" (вільні електрони можуть взаємодіяти з квантами світла).
По-третє, вільні електрони забезпечують металів хорошу електропровідність. Висока теплопровідність металів теж пояснюється наявністю вільних електронів в міжатомних просторі - вони легко "відгукуються" на зміни енергії і сприяють її швидкому переносу в кристалі.
Спрощена модель електронної будови металевого кристала.
** ** ** ** На прикладі металу натрію розглянемо природу металевої зв'язку з точки зору уявлень про атомні орбиталях. У атома натрію, як і у багатьох інших металів, є недолік валентних електронів, зате є вільні валентні орбіталі. Єдиний 3s-електрон натрію здатний переміщатися на будь-яку з вільних і близьких по енергії сусідніх орбіталей. При зближенні атомів в кристалі зовнішні орбіталі сусідніх атомів перекриваються, завдяки чому віддані електрони вільно переміщаються по всьому кристалу.
Однак "електронний газ" зовсім не безладний, як може здатися. Вільні електрони в металевому кристалі знаходяться на перекриваються орбиталях і в якійсь мірі усуспільнюється, утворюючи подобу ковалентних зв'язків. У натрію, калію, заліза та інших металевих s-елементів обобществленних електронів просто мало, тому їх кристали неміцні і легкоплавкі. Зі збільшенням числа валентних електронів міцність металів, як правило, зростає.
Таким чином, металевий зв'язок схильні утворювати елементи, атоми яких на зовнішніх оболонках мають мало валентних електронів. Ці валентні електрони, які здійснюють металеву зв'язок, усуспільнено настільки, що можуть переміщатися по всьому металевому кристалу і забезпечують високу електропровідність металу.
Кристал NaCl не проводить електричний струм, тому що в просторі між іонами немає вільних електронів. Всі електрони, віддані атомами натрію, міцно утримують біля себе іони хлору. В цьому одна з істотних відмінностей іонних кристалів від металевих.
Те, що ви тепер знаєте про металевої зв'язку, дозволяє пояснити і високу гнучкість (пластичність) більшості металів. Метал можна розплющити в тонкий лист, витягнути в дріт. Справа в тому, що окремі шари з атомів в кристалі металу можуть відносно легко ковзати один по іншому: рухливий "електронний газ" постійно пом'якшує переміщення окремих позитивних іонів, екрануючи їх один від одного.
Зрозуміло, нічого подібного не можна зробити з кухонною сіллю, хоча сіль - теж кристалічна речовина. В іонних кристалах валентні електрони міцно пов'язані з ядром атома. Зрушення одного шару іонів щодо іншого призводить до зближення іонів однакового заряду і викликає сильне відштовхування між ними, в результаті чого відбувається руйнування кристала (NaCl - крихке речовина).
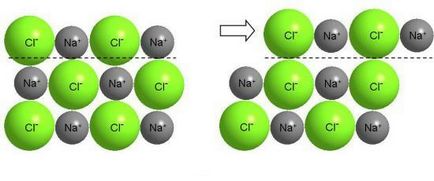
Зрушення шарів іонного кристала викликає появу великих сил відштовхування між однойменними іонами і руйнування кристала.