У США більше 400 000 щорічних смертей класифіковані як раптові і найімовірніше викликані аритміями. Найбільш жізнеугрожающих є шлуночковатахікардія. У пацієнтів з шлуночковими аритміями внаслідок коронарної патології використання імплантованих кардіовертерів-дефібриляторів (ІКД) для запобігання раптової смерті виявилося досить ефективним.
Клінічні дослідження Cardiac Arrest Study Hamburg (CASH), Antiarrhythmics Versus Implantable Defibrillators (AVID), Multicenter Unsustained Tachycardia Trial (MUSTT), Canadian Implantable Defibrillator Study (CIDS) і Multicenter Automatic Defibrillator Implantation Trial (MADIT) довели переваги використання імплантованих кардіовертерів-дефібриляторів перед медикаментозним лікуванням і тільки дослідження CABG Patch Trial, порівнює результати АКШ і АКШ з ІКД, не виявило переваг використання останнього.
Фізіологія шлуночкових тахікардій
Після інфаркту міокарда утворюється сполучнотканинний рубець, де швидкість передачі електричного сигналу сповільнюється і створюється можливість виникнення кола re-entry, який може бути перерваний антиаритмічними препаратами, катетерной або хірургічними аблацією. Інші форми шлуночкової тахікардії та фібриляції шлуночків обумовлені порушенням автоматизму внаслідок ішемії міокарда, збільшенням напруги стінки лівого шлуночка і Міопатичні пошкодженням кардіоміоцитів. Застосування антиаритмічнихпрепаратів I класу після інфаркту міокарда здатне збільшити смертність внаслідок проаритмічної ефектів.
У хворих на ІХС з відносно хорошою шлуночкової функцією і шлуночковими аритміями, які провокуються фізичним навантаженням при доведеній в цей момент ішемією, одна тільки реваскуляризація міокарда, усуваючи ішемію як можливий пусковий механізм шлуночкової тахікардії, покращує прогноз. Проведене після АКШ електрофізіологічне обстеження дозволяє виявити хворих, яким все ж буде необхідна імплантація ІКД.
Іншим підходом в лікуванні шлуночкової тахікардії є проведення транспредсердной картографії на интактном серце, що дозволяє отримати більш повну картину порушень ритму в межах відносно короткого проміжку часу. Для цього використовується балон з великою кількістю електродів, який вводиться через невеликий розріз лівого передсердя і мітральний клапан в лівий шлуночок і наповнюється до досягнення хорошого контакту електродів з ендокардит. Тиск в балоні контролюється для запобігання субендокардіальному ішемії.
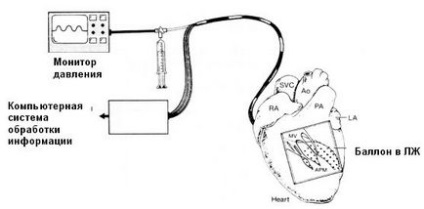
Ендокардіальних картування лівого шлуночка
Отримана інформація може надаватися як ряд ізосінхронних карт з кольоровим маркуванням в реальному режимі часу. Електростимуляція в певних точках ендокарда лівого шлуночка дозволяє виявити не тільки ділянку, відповідальний за індукцію шлуночкової тахікардії, а й область, де виникає коло re-entry. На картограма вона представлена в заштрихованном вигляді. Ця ділянка підлягає аблации.
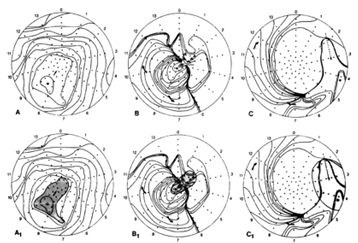
Результати ендокардіального картування лівого шлуночка
Результати картографічних досліджень показують, що область, відповідальна за розвиток шлуночкової тахікардії, зазвичай розташовується в прикордонній зоні між життєздатним міокардом і постінфарктним рубцем і відповідає наявності живих волокон міокарда в фіброзної тканини. У більшості пацієнтів ІХС зі зниженою функцією лівого шлуночка і шлуночковими аритміями аритмогенного вогнище розташовується в міжшлуночкової перегородки в області акинезией або дискінезії міокарда в зоні верхівки серця.
Оскільки картографія - трудомісткий процес, що вимагає спеціалізованого обладнання, у багатьох центрах використовується візуальний підхід до видалення вогнищ шлуночкової тахікардії. Він полягає в резекції рубця (аневризми) з подальшою реконструкцією порожнини лівого шлуночка. Локалізація рубця міокарда в міжшлуночкової перегородки поблизу задньої папілярної м'язи може обмежити обсяг резекції, а його розширення з наступним протезуванням мітрального клапана знижує виживання пацієнтів у віддаленому післяопераційному періоді.
Різні альтернативні методи ліквідації вогнищ шлуночкової тахікардії засновані на руйнуванні тканини в прикордонній зоні між рубцем і життєздатним міокардом також мають потенційні негативні ефекти на структуру і функцію лівого шлуночка. До таких методів належать:
- резекція ендокарда (видалення видимого внутрисердечного рубця);
- Кріоаблація. Глибина пошкодження тканини, досягнутої при Кріоаблація залежить від температури і експозиції. Використання 15 мм зонда, охолодженого до -60 ° C з експозицією 2 хв. призводило до деструкції тканини на 2 мм в глибину при нормотерміческой перфузії і до 6 мм - при холодової кардіоплегії;
- лазерна фотоаблація;
- радіочастотна абляція.
Чим більше радикально виконана процедура, тим менш імовірний рецидив шлуночкової тахікардії. Разом з тим додаткове пошкодження може мати негативний ефект на функцію лівого шлуночка або мітрального клапана.
Важливою частиною хірургічного підходу у пацієнтів з ІХС, шлуночковими аритміями і зниженою функцією лівого шлуночка на додаток до аблации аритмогенних вогнищ і реваскуляризації міокарда є ремоделирование лівого шлуночка і відновлення компетентності мітрального клапана. Після ліквідації аритмогенних ділянок обов'язково повинна бути виконана реконструкція лівого шлуночка з відновленням його нормальних розмірів і геометрії з використанням описаних раніше методів. Мітральна реконструкція із застосуванням різних видів пластики, як правило, усуває недостатність клапана. Потенційні переваги такого підходу полягають у зниженні напруги стінки лівого шлуночка і зменшення споживання кисню міокардом. Зміна орієнтації волокон міокарда призводить до збільшення його скорочувальної здатності. Механічна розвантаження зі зменшенням дилатації протилежної стінки лівого шлуночка також може запобігати аритмії.
Результати хірургічного лікування
Пацієнти з шлуночкової тахікардією відносяться до групи хворих з високим ризиком. Середня фракція викиду лівого шлуночка оперованих хворих складає 25-30%. Госпітальна летальність при виконанні комплексної реконструкції, що включає абляцію аритмогенних вогнищ, коливається в діапазоні від 2% до 10%. Фактори ризику несприятливих результатів включають літній вік, низьку фракцію вигнання, виражену серцеву недостатність і нижній інфаркт міокарда в анамнезі. Рецидив аритмії відзначений у 10-20% хворих, свобода від раптової смерті протягом 5-річного періоду спостереження склала 90%, виживаність - 70-80%. Пацієнти з рецидивом шлуночкових тахікардій потребують лікування аміодароном або імплантації ІКД.
Катетерная аблация ліквідує шлуночкову тахікардію у 82% хворих. Безпосередня летальність - 1,8%, але у 8% пацієнтів розвиваються ускладнення, включаючи шок, гостру ішемію міокарда або тампонаду перикарда. 5-річна виживаність становить 49%, а рецидиви шлуночкової тахікардії відзначені у 72% пацієнтів. З наведених даних видно, що результати катетерной аблации значно поступаються результатам комплексного хірургічного лікування.
Численні рандомізовані дослідження, які порівнюють результати імплантації кардіовертера-дефібрилятора і комплексної хірургічної реконструкції у пацієнтів з шлуночковими аритміями і зниженою фракцією викиду, показали, що 5-річна виживаність в групі хворих з ІКД становила 60%, що також значно нижче, ніж в хірургічній групі.
Таким чином, у пацієнтів ІХС з низькою фракцією викиду і шлуночковими тахіаритміями рекомендується комплексний хірургічний підхід з повною реваскуляризацією міокарда, ремоделированием лівого шлуночка і пластикою мітрального клапана в поєднанні з хірургічною аблацією аритмогенних вогнищ. Під час виконання хірургічного втручання перегородка повинна бути досліджена на наявність рубця. Останній необхідно резецировать з проведенням Кріоаблація по периферії лінії резекції. В післяопераційному періоді рекомендується електрофізіологічне дослідження та під час виникнення шлуночкової тахікардії при проведенні провокаційної проби показано використання аміодарону або імплантація кардіовертера-дефібрилятора.
Імплантований імплантованого дефібрилятора серця
За останні роки стався серйозний технологічний прогрес в конструкції ІКД: термін служби акумулятора був збільшений більш 5 років, розмір і вага зменшені до величини ЕКС. електроди з епікардіальних, що вимагають торакотомии, стали ендокардіальний з можливістю двухфазного розряду. З'явилася можливість програмування функцій, властивих ЕКС - збереження ЕКГ, VVI, DDD і антітахікардітіческая функції і т.д. Це дозволило значно знизити травматичність операції і поліпшити віддалені результати. Терапевтична ефективність ІКД добре доведена, однак ІКД доріг ($ 6 000-12 000), вимагає зміни способу життя і викликає дискомфорт, тому доцільність його профілактичної імплантації спірна.
Імплантація кардіовертера-дефібрилятора показана хворим, які перенесли зареєстровану зупинку серця у відсутності гострого інфаркту міокарда та хворим з неефективністю антиаритмічнихпрепаратів або що не підлягають хірургічній аблации за результатами електрофізіологічних досліджень. Разом з тим, у багатьох пацієнтів, які перенесли зупинку серця, після провокаційної стимуляції не розвивається шлуночковатахікардія, у інших хворих з синкопе в анамнезі - розвивається провоцируемая шлуночковатахікардія, але немає клінічних проявів аритмії. У зв'язку з цим після проведення досліджень MADIT і MADIT II показання до імплантації ІКД були розширені. Як показань додатково запропоновані провоцируемая шлуночковатахікардія, короткі періоди шлуночкової тахікардії або низька скорочувальна здатність міокарда (ФВ <30%) у больных с инфарктом миокарда в анамнезе.
Імплантований імплантованого дефібрилятора серця
В ІКД використовуються дві системи електродів: одна для сприйняття шлуночкового сигналу або його стимуляції, інша - з метою доставки енергії дефібриляції. Ці системи зазвичай біполярні, але в деяких ІКД використовується однополярний шлуночковий електрод. Всі вживані електроди мають активну фіксацію. Програмний алгоритм дозволяє розрізняти надшлуночкові аритмії від шлуночкової тахікардії. Для цього додатково використовуються біполярний передсердний електрод, який при необхідності забезпечує предсердную стимуляцію. У пацієнтів з високим порогом дефібриляції додатково використовується підшкірний електрод.
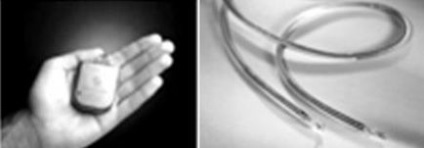
Імплантований кардівертер-дефібрилятор з електродами
Імплантований кардівертер-дефібрилятор містить високоенергетичну батарею і конденсатор для посилення вихідного напруги до 600-800 Вт (35-40 Дж). Двофазний (позитивні і негативні фази) розряд підвищує ефективність дефібриляції. Пристрій включає інтегральні схеми і антену телеметрії і підтримує широкий діапазон налаштувань діагностичних і терапевтичних функцій.
Більшість пацієнтів, які потребують імплантації ІКД, мають високий ризик операції. Передопераційна підготовка спрямована на профілактику ішемії міокарда, лікування серцевої недостатності і супутніх захворювань. Оскільки ішемія міокарда має більш високий ризик, ніж фракція вигнання нижче 15%, імплантація ІКД іноді виконується на тлі ЧТКА і контрпульсації.
Техніка операції не відрізняється від імплантації ЕКС. Найважча частина операції імплантації ІКД для пацієнта - виникнення і купірування шлуночкової тахікардії. У випадках, коли для цього потрібно багаторазові розряди дефібрилятора, застосовується ендотрахеальний наркоз. Для профілактики пошкодження системи через утворення дуги при зовнішньої дефібриляції нашкірні електроди для дефібриляції не повинні розташовуватися в безпосередній близькості від ІКД.
Розрізом 6 см в підключичної області в s.deltopectoralis оголюється v.cephalica. Електроди проводяться через інтродьюсер в верхівку правого шлуночка і праве передсердя і фіксуються. Ці маніпуляції можуть провокувати фібриляцію шлуночків. Проводяться стандартні проби порога дефібриляції електрокардіостимуляції і величини внутрисердечного потенціалу. У цей час проводиться постійна флюороскопія для контролю можливого зсуву електрода, особливо якщо в цей момент необхідна зовнішня дефібриляція.
Вимірювання порога дефібриляції вимагає індукції шлуночкової тахікардії. Поріг повинен бути, принаймні, на 10 Дж менше, ніж максимальна потужність ІКД. Якщо поріг дефібриляції при оптимальному розташуванні внутрішньосерцевих електродів вище цього рівня, потрібно використання додаткового підшкірного електрода для кращого розподілу потоку енергії по бічних стінок лівого шлуночка. Вимірювання порога дефібриляції може провокувати зниження серцевого викиду.
Лівобічний пневмоторакс, який може виникнути внаслідок технічних помилок пункції підключичної вени, є сильним ізолятором, значно збільшує поріг дефібриляції і може бути причиною неефективної кардіоверсії. Це необхідно враховувати, так як іншими причинами високого порогу дефібриляції є ішемія міокарда, електромеханічна дисоціація, погане розподіл розряду. Нездатність відновити ритм - критичне становище під час операції, яка може зажадати відкритого масажу серця або штучного кровообігу. поки рішення не буде знайдено.
Імплантований кардівертер-дефібрилятор поміщається в підшкірний кишеню в області великого грудного м'яза. Якщо необхідно його розміщення в верхньому лівому квадранті черевної порожнини під прямим м'язом живота, в підшкірній клітковині по передній поверхні грудної клітини формується тунель для проведення електродів. Останні надійно фіксуються в місці виходу з вени для запобігання їх дислокації. Профілактика інфекції під час операції досягається внутрішньовенним веденням ванкомицина або гентаміцину. Антибіотикопрофілактика триває протягом 7 діб пероральним прийомом цефалоспоринів.
Для підтвердження стабільності роботи ІКД через 7-14 днів після виписки зі стаціонару може знадобиться повторне дослідження порога дефібриляції і программація. Персонал повинен знати, як використовувати магніт, щоб заборонити розряди ІКД, які виникають при дислокації електрода в правий шлуночок або суправентрикулярної аритмії. Перевірка з тестуванням заряду генератора контролю роботи конденсатора, сенсорних і стимулюючих функцій ІКД проводиться з 1-3 місячними інтервалами.
результати
Госпітальна летальність після імплантації ІКД становить 1%. Ускладнення включають інфаркт міокарда, зупинку серця, дислокацію електрода, інфекцію, і порушення венозного відтоку.
В післяопераційному періоді пацієнтів турбує дискомфорт і дистрес через розрядів дефібрилятора. У той час як багато хворих повністю задоволені можливістю порятунку від злоякісної аритмії, інші перебувають в постійному неспокої через постійний стрес.
Термін служби акумулятора ІКД - понад 60 місяців. Заміна проводиться під місцевою анестезією з седацией під час вимірювання порога дефібриляції.
Порушення функції електродів прогресує з тривалістю терміну роботи ІКД. У 50% пацієнтів потрібна заміна електродів протягом 10-річного періоду спостереження. Причинами порушення функції електродів є перелом електрода, високий поріг дефібриляції, порушення детекторной функції і exit block. Збільшення порога дефибрилляции може бути наслідком дилатації серця, яке переміщує лівий шлуночок вліво, далеко від електрода. Протягом 2-річного періоду спостереження частота розвитку дислокації шлуночкового електрода становить 7%, перелому електрода - 6%. Як правило, розвиток зазначених ускладнень диктує заміну електродів.
Лікування шлуночкової тахікардії з використанням ІКД досить дорого, але вартість медикаментозної терапії також істотна. Необхідно значне зниження вартості генераторів ІКД перш, ніж цей спосіб лікування знайде широке застосування.
Проф. д.м.н. Островський Ю.П.