Хімія Органічна. Молекулярна Структура А. ХІМІЧНІ ЗВ'ЯЗКИ ВУГЛЕЦЮ
Хімічна природа вуглецю, проміжна між металами і типовими неметалами, дозволяє йому утворювати ковалентні зв'язки з великим числом елементів, найчастіше з воднем, киснем, азотом, галогенами, сіркою і фосфором. Вуглець утворює зв'язки з високим ступенем іонного характеру з більш електропозитивні металами, але такі речовини є високореакціонноспособнимі і використовуються як проміжні сполуки в синтезі. Вуглець-вуглецеві зв'язки мають ковалентний характер і бувають прості (одинарні), подвійні, потрійні і ароматичні
(Див. Молекул Будова).
Ароматичні системи. Бензол - родоначальник класу ароматичних сполук - має унікальну стабільність і вступає в хімічні реакції, відмінні від реакцій неароматичних систем. Є й інші ароматичні системи, найбільш звичайні з яких мають p-орбіталі, доступні для освіти p-зв'язків, на кожному атомі кільця. П'ятичленні кільцеві системи з двома сполученими (тобто чергуються з простими) подвійними зв'язками і п'ятим атомом, що несе неподеленную пару електронів, є також ароматичними за своїми властивостями. Нижче представлені деякі з таких систем:
Поняття ароматичності узагальнив німецький хімік Е. Хюккель. Згідно з правилом Хюккеля, плоскі циклічні пов'язані системи з числом p-електронів, рівним 4n + 2, ароматних і стабільні, а такі ж системи з числом p-електронів 4n - антіароматічни і нестійкі.
Стабільність циклічних систем. Валентний кут (кут між зв'язками) в ненапруженому фрагменті С-С-С становить 109В °, і кільця, в яких зберігається це значення, більш стабільні, ніж ті, де кути сильно відхиляються від цього значення. Напруга, що виникає в циклічних системах в результаті спотворення валентних кутів, носить назву байеровского - по імені німецького хіміка А. Байєра, вперше який запропонував таке пояснення стійкості насичених кілець. Так, в тричленних кільцях, де валентний кут складає всього 60 °, кільця сильно напружені і легко розриваються; деякі з них реакцій нагадують реакції подвійного зв'язку С = С. Четирехчленние кільця також напружені (валентний кут 90 °), але не настільки сильно. П'ятичленні кільця майже пласкі і їх кути рівні 108В °; тому вони ненапряжен і стабільні. У таких шестичленних кільцях, як циклогексан, атоми вуглецю лежать в одній площині; такі цикли є складчастими, що зменшує напругу кільця. П'яти- і шестичленні кільця є найбільш звичайними. Великі кільця також здатні знижувати кутовий напругу шляхом утворення складок, але в деяких з них (від семи до двенадцатичленная) атоми водню на протилежних сторонах кільця зближуються настільки, що їх відштовхування робить з'єднання менш стабільним (прелоговское напруга, на ім'я швейцарського хіміка В.Прелога , який відкрив цей ефект).
Таутомерія. Якщо молекулу або іон можна представити у вигляді декількох структур, що відрізняються один від одного тільки розподілом електронів, ці структури називаються резонансними, причому резонансні форми не перебувають в рівновазі одна з іншого, просто справжня електронна структура молекули є чимось середнім між цими крайнощами. Однак є ситуації, в яких атоми переміщаються в молекулі при звичайних умовах так швидко, що між різними молекулярними формами мимовільно встановлюється рівновага. Таке явище називається таутомерією. Прикладом служить рівновагу між кетоном і Енола (кето-енольная таутомерія):
Тут два з'єднання розрізняються тільки розташуванням катіона водню і пари електронів (в p-зв'язку). Рівновага встановлюється швидко, але сильно зрушено в бік кетоформи. Отже, спирти зі структурою -C = C-OH зазвичай нестійкі і швидко перетворюються в кетоформу, якщо немає якихось структурних особливостей, що стабілізують енольную форму, наприклад в фенолах, які при переході в кетоформу втрачали б свій ароматичний характер:
Таутомерія звичайна в молекулах, які мають структуру -CH = X або -C = XH, де X - це S, О або N. Так, молекула H2C = C (NH2) -CH3 швидко перегруповуються в H3C-C (= NH) - CH3, а іміди RC (OH) = NH перегруповуються в аміди RC (= O) NH2. Таутомерія звичайна в таких біологічно важливих гетероциклічних системах, як барбітурова кислота і споріднені з нею з'єднання:
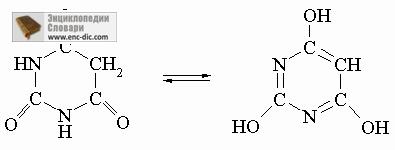
Інші швидкі рівноваги. Відомі й інші швидкі рівноваги між молекулами з родинними структурами. Якщо при одному і тому ж вуглецевому атомі знаходяться будь-які дві з груп OH, SH або NH2, з'єднання зазвичай нестійка в порівнянні з двоесвязной формою:
Є випадки, коли ця рівновага зрушено в бік дигідрокси-з'єднання. Газоподібний формальдегід має структуру CH2 = O, але у водному розчині він приєднує молекулу води, знаходячи HO-CH2-OH в якості переважної форми. Хлоральгідрат Cl3CCH (OH) 2 стабільний в дігідроксільной формі в результаті електроноакцепторні впливу трьох атомів хлору.
Б. ізомерів
Ізомерія вуглецевого ланцюга. Молекули, які відрізняються тільки розгалуженням вуглецевого ланцюга, називають ланцюговими изомерами. Приклад вже був дан - це ізомерна пара н-бутан і ізобутан.
Ізомерія функціональних груп. Молекули з однаковими брутто-формулами, але різними функціональними групами є функціональними изомерами, наприклад етиловий спирт C2H5OH і диметиловий ефір CH3-O-CH3.
Ізомерія положення. Позиційні ізомери мають однакові брутто-формули і функціональні групи, але положення функціональних груп в їх молекулах різні. Так, 1-хлорпропан CH3CH2CH2Cl і 2-хлорпропан CH3CHClCH3 є позиційними изомерами.
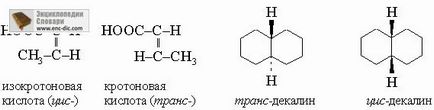
Геометрична ізомерія. Геометричні ізомери складаються з однакових атомів, з'єднаних в одній і тій же послідовності, але відрізняються просторовим розташуванням цих атомів щодо подвійних зв'язків або кілець. Цис-транс-ізомерія олефінів і син-анти-ізомерія оксимов відносяться до цього типу.
Допомога пошукових систем