Більшість хімічних реакцій не протікає до кінця. Реакції, які можуть одночасно протікати в двох взаємно протилежних напрямках, називаються оборотними. Якщо швидкості таких реакцій ста-нут рівними,
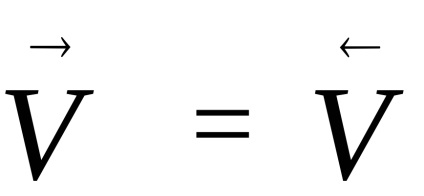
Стан рівноваги характеризує ту межу, до якого в дан-них умовах реакція, раз почалася, відбувається мимовільно (ΔG <0). Если в системе наступило химическое равновесие, то дальнейшее изменение изобарно-изотермического потенциала происходить не будет (см. рис.1)
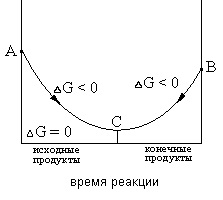
Рис.1 Зміна ΔG в міру протікання реакції

Для гомогенної оборотної реакції АА + ВВ

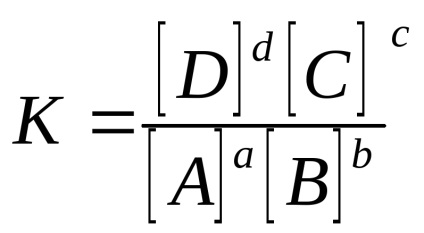
в разі газових систем:
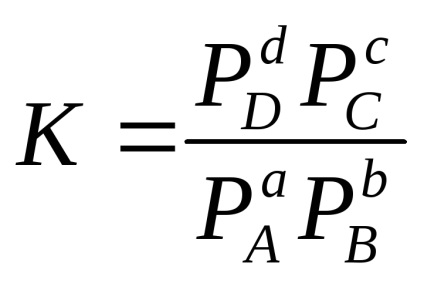
Наприклад, для реакції:
Особливістю гетерогенного хімічного рівноваги є відсутність в константах рівноваги членів, що відносяться до твердих речовин.
При даній температурі парціальні тиску реагентів, знаходячи-трудящих в конденсованому (твердому і рідкому) стані, постійні і не залежать від кількості реагентів. Тому ці парціальні тиску зазвичай включають в константу рівноваги. Так, для реакції
СаСО3 (т) = СаО (т) + СО2 (г);
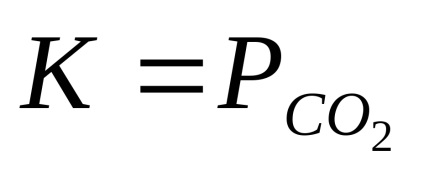
Константа рівноваги пов'язана зі зміною ізобарно-ізотермічного потенціалу хімічної реакції ΔG ° співвідношенням:
Так як ΔG ° = ΔНº - TΔS °; RlnK = ΔS ° - ΔНº / T
звідси К = е -Δ H º / RT e Δ S º / R
В умовах рівноваги оборотної реакції ΔG ° =? Н ° - Т · ΔS ° = 0 можна розрахувати температуру, при якій настає рівновага
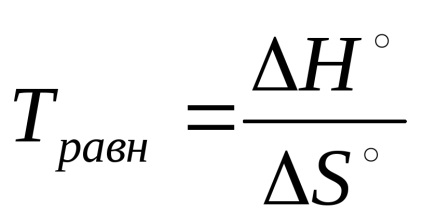
З цих рівнянь випливає, що константа рівноваги дуже чутливих-тельна до зміни температури. Вплив на константу рівноваги при-пологи реагуючих речовин визначає її залежність від ентальпійного (ΔНº) і ентропійного (ΔS °) факторів.
Від концентрації реагентів і від тиску (якщо воно не дуже високо-сяк) константа рівноваги не залежить. При зміні умов (температури, тиску-ня, концентрації) стан рівноваги порушується.
Зсув рівноваги в залежності від зміни умов в загальному вигляді визначається принципом Ле-Шательє: якщо на систему, що знаходиться в рівновазі, впливають ззовні шляхом зміни будь-якого з умов, що визначають рівновагу, то воно зміщується в напрямку того процесу, перебіг якого послаблює ефект виробленого дії. Отже, підвищення температури зміщує рівновагу в бік ендотермічного процесу, а зниження - в сторону екзотермічної процесу. З огляду на, що? Н = -Q
RlnК = ΔS ° + Q / T (для екзотермічної реакції).
RlnK = ΔS ° - Q / T (для ендотермічної реакції).
Взагалі, в областях високих температур характерні ендотерміче-ські реакції, а в областях низьких температур - екзотермічні. Пови-шення тиску зміщує рівновагу в бік утворення меншого ко-лічества газоподібних молекул, підвищення концентрації вихідних речовин - в бік утворення продуктів реакції. При протилежному впливі рівновагу буде зміщуватися, відповідно, в сторону обра-тання вихідних речовин. Наприклад, для екзотермічної реакції
.
для зміщення рівноваги в бік утворення аміаку необхідно збільшити концентрації вихідних речовин (причому найбільш вигідно збільшити концентрацію водню), зменшити концентрацію аміаку, знизити температуру або збільшити тиск.
Адсорбція - процес поглинання одного речовини поверхнею іншого внаслідок нескомпенсованність силових полів частинок в поверхневому шарі (на кордоні розділу фаз).
Речовини, частинки якого поглинаються (газ, рідина, розчинений компонент), називають адсорбатом, а поглинач - адсорбентом.
Взаємодії між частинками адсорбату і адсорбенту можуть мати різний характер. Залежно від природи цієї взаємодії розрізняють адсорбцію фізичну і хімічну (хемосорбцію).
При фізичної адсорбції частинки адсорбату і адсорбенту зв'язуються щодо неміцними міжмолекулярними силами взаємодії (силами Ван-дер-Ваальса). Прикладом фізичної адсорбції є адсорбція газів або розчинених речовин активованим вугіллям.
При хемосорбції частки адсорбата і адсорбенту пов'язані міцнішими силами зчеплення за рахунок виникає хімічної взаємодії, що приводить до утворення нової речовини. Прикладом хемосорбції може служити адсорбція кисню металами. Процес відриву частинок адсорбату від поверхні адсорбенту, тобто явище, зворотне адсорбції, називають десорбцією. Якщо в системі «адсорбат - адсорбент» при заданих умовах швидкість адсорбції дорівнює швидкості десорбції, стан системи називають адсорбційним рівновагою. Хемосорбція протікає необоротно.
Кількісно адсорбцію висловлюють в молях адсорбата на одиницю площі поверхні адсорбенту (моль / м 2) або в молях адсорбата на одиницю маси абсорбенту (моль / г).
Величина адсорбції залежить від природи адсорбенту і адсорбату, температури і концентрації (або тиску) адсорбата. Криву залежності величини адсорбції від рівноважних концентрацій з або тисків p адсорбата при постійній температурі Т називають ізотермою адсорбції: Г = f (c) або Г = f (p) при T = const.
Залежність величини адсорбції від концентрації адсорбенту (T = const) виражається рівнянням Ленгмюра (за умови, що поверхня адсорбенту однорідна).
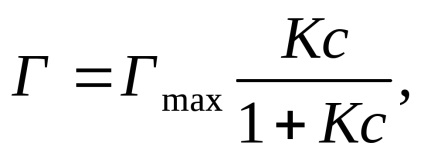
де Г-величина адсорбції; Гmax - максимальна величина адсорбції, обумовлена поверхнею адсорбенту; К - константа адсорбційної рівноваги; с - рівноважна концентрація адсорбенту.
Адсорбція зростає зі збільшенням концентрації або тиску адсорбирующихся речовин згідно изотерме адсорбції (Рис.2, а).
Висловивши рівняння Ленгмюра у вигляді:
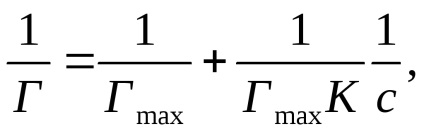
отримують лінійну залежність 1 / Г від 1 / с (Рис.2, б).
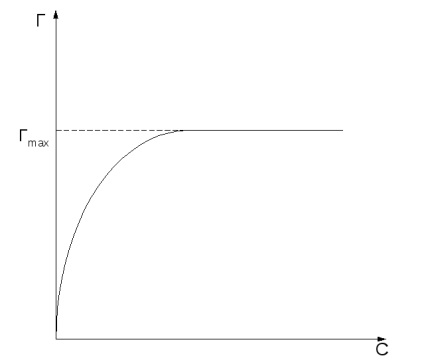
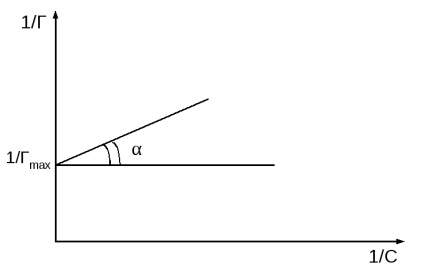
Рис.2 Ізотерма Ленгмюра в двох формах.
На осі ординат відсікається відрізок, рівний 1 / Гmax. а tgα = 1 / K · Гmax
З графіка, побудованого в координатах 1 / Г - 1 / с, розраховують максимальну величину адсорбції (Гmax), a потім по рівнянню Ленгмюра константу адсорбційної рівноваги (К).
При високих значеннях концентрацій (тисків) величина К · с »1
(До · р »1) рівняння Ленгмюра набирає вигляду Г = Гmax.
Адсорбція знаходить широке застосування на морському флоті, наприклад, при очищенні газів і рідин від різних домішок; при обробці суднових технологічних вод і для поліпшення експлуатаційних показників мастильних матеріалів, для вирішення екологічних завдань на флоті і т.д.