Під хімічним зв'язком розуміють різні види взаємодій, що обумовлюють стійке існування двох- і багатоатомних сполук: молекул, іонів, кристалічних речовин. За своєю природою хімічний зв'язок є взаємодія між позитивно зарядженими ядрами і негативно зарядженими електронами, а також електронами один з одним. Основні види хімічного зв'язку: ковалентний, іонна, металева. Для опису ковалентного зв'язку використовують два методи - метод валентних зв'язків (МВС) і метод молекулярних орбіталей (ММО).
В основі методу ВС лежать наступні положення:
1.В утворенні ковалентного зв'язку беруть участь тільки неспарені електрони двох атомів з протилежно спрямованими спинами (обмінний механізм утворення зв'язку), або електронна пара одного атома
- донора і вільна орбіталь іншого атома - акцептора (донорно-акцепторні механізм).
2.Ковалентная хімічний зв'язок між двома атомами виникає як результат перекривання атомних орбіталей з утворенням електронних пар (усуспільнення двох електронів).
Відповідно до теорії валентних зв'язків ковалентний зв'язок спрямована в бік максимального перекривання атомних орбіталей взаємодіючих атомів.
Геометрична (просторова) структура молекули, що складається з більш ніж двох атомів, обумовлена взаємним розташуванням атомних орбіталей, що беруть участь в утворенні хімічних зв'язків. Молекула АВ2 може мати лінійну. або кутову структуру (а). Молекула АВ3 може мати форму правильного трикутника (б), тригональной піраміди (в). Молекула АВ4 - форму тетраедра (г).
Просторова структура молекули визначається видом гібридизації валентних орбіталей центрального атома і числом неподіленого електронних пар, що містяться в валентном електронному шарі.
Приклад 1. Опишіть з позицій методу валентних зв'язків будова молекул: а) РН3. б) BBr3. Які атомні орбіталі беруть участь в утворенні хімічних зв'язків? Вкажіть тип гібридизації (якщо гібридизація має місце). Яка просторова структура цих молекул?
Рішення. а) Освіта молекули РН3.
Напишемо електронні формули атомів, що утворюють молекулу PH3, в основному (нормальному) стані: 15 Р 1s 2 2s 2 2p 6 3s 2 3p 3; 1 Н 1s 1
Електронно-графічні формули зовнішнього рівня цих атомів:
У даній молекулі центральним атомом є атом фосфору, у якого в освіті трьох хімічних зв'язків беруть участь тільки p - орбіталі, розташовані на одному підрівні і володіють однаковою формою і однаковою енергією. Отже, в молекулі РН3 гібридизація відсутній.
Для наочного зображення валентних схем можна використовувати наступний спосіб. Електрони, що знаходяться на зовнішньому електронному шарі, позначають точками, що розташовуються навколо хімічного символу атома. Загальні для двох атомів електрони показують точками, поміщається між їх хімічними символами; подвійна або потрійна зв'язок позначається відповідно двома або трьома парами спільних точок. Застосовуючи ці позначення, освіту молекули РН3 можна змалювати таку картину:
Цю схему можна записати інакше: Н - Р - Н, де кожна пара електронів, що зв'язує два атоми, відповідає одній риски, що зображає ковалентний зв'язок в структурних формулах.
р - електронні хмари атома фосфору орієнтовані під взаємно напрямках (вздовж осей координат) -рх. ру. рz і мають гантелевідной форму. У атома водню в утворенні хімічного зв'язку Р-Н бере участь s-електрон, що має сферичну форму хмари. При утворенні молекули РН3 відбувається перекривання р - електронних хмар атома фосфору з s-електронними хмарами трьох атомів водню:
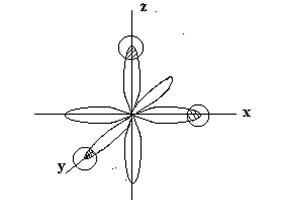
Відповідно до вимог методу валентних зв'язків три зв'язку
Р - Н повинні розташовуватися під кутами, близькими до 90 ° С. Отже, просторове розташування одинарних зв'язків визначає геометричну структуру молекули. Молекула РН3 повинна мати форму тригональной піраміди:
У вершині піраміди знаходиться атом фосфору, а в вершинах підстави атоми водню.
б) Освіта молекули ВВr3. У молекулі ВВr3 центральним атомом є атом бору.
Електронні формули атомів:
5 У 1s 2 2s 2 2p 1 35 Br 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5
Електронно-графічні формули зовнішнього рівня мають вигляд:
Оскільки бор в з'єднанні трехвалентен, запишемо електронно-графічну формулу атома бору в збудженому стані:
В освіті трьох хімічних зв'язків в молекулі ВВr3 беруть участь одна s- і дві р-орбіталі, розташовані на різних подуровнях і володіють різною формою і різної енергією:
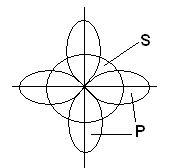
У цьому випадку замість вихідних однієї s- і двох p-орбіталей збудженого атома бору утворюється три рівноцінні гібридні орбіталі (sp 2 - гібридизація). При sp 2 гібридизації гібридні електронні хмари розташовуються в напрямках, що лежать в одній площині і орієнтованих під кутами 120 ° один до одного:
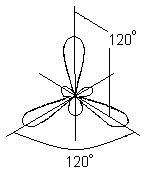
Цьому типу гібридизації відповідає утворення плоскої трикутної молекули. При утворенні молекули ВВr3 відбувається перекривання трьох гібридних орбіталей атома бору з р - електронними орбиталями трьох атомів брому:
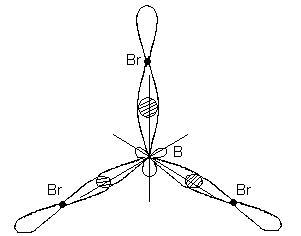
Молекула ВВr3 має форму плоского правильного трикутника, в центрі якого розташований атом бору, а в вершинах - атоми брому. Всі три зв'язку В-Br в молекулі ВВr3 рівноцінні.
Приклад 2. Намалюйте енергетичні схеми утворення молекули F2 і молекулярного іона F2 + за методом молекулярних орбіталей. Скільки електронів знаходиться на пов'язують і розпушують орбиталях? Чому дорівнює порядок зв'язку в цих частках? Вкажіть їх магнітну характеристику (парамагнетизм або диамагнетизм).
Рішення. Відповідно до теорії молекулярних орбіталей (ММО) молекула розглядається як сукупність позитивно заряджених ядер і негативно заряджених електронів, де кожен електрон рухається в полі інших електронів і всіх ядер.
Описати молекулу відповідно до теорії ММО - це значить визначити тип її орбіталей, їх енергії і з'ясувати характер розподілу електронів по орбіталях.
При утворенні молекули виникають молекулярні орбіталі двох видів - зв'язуючі і розпушують. Якщо при утворенні молекули з атомів перехід електрона на молекулярну орбіталь буде супроводжуватися зменшенням енергії, то така молекулярна орбіталь є зв'язує. Якщо перехід електрона на молекулярну орбіталь супроводжується збільшенням енергії, то така молекулярна орбіталь буде розпушують.
Електрони в молекулах розташовуються на s- і p- молекулярних орбіталях. s-орбіталі можуть бути утворені перекриванням s - атомних орбіталей і перекриванням 2рх - атомних орбіталей. При цьому утворюються молекулярні орбіталі: s-зв'язуючі (sсв) і s-розпушують (sразр). При перекривання 2ру і 2рz атомних орбіталей утворюються молекулярні орбіталі: pсв2Ру. pсв2Рz і pраз2Ру. pраз2Рz. Порядок розміщення електронів по молекулярним орбиталям той же, що і в разі атомних орбіталей, тобто відповідає принципу найменшої енергії, принципу Паулі, правилом Хунда.