Хімічний елемент - це сукупність атомів з однаковим зарядом атомних ядер і однаковим числом електронів в атомній оболонці. Атомне ядро складається з протонів. число яких дорівнює атомному номеру елемента, і нейтронів. число яких може бути різним [1]. Кожен хімічний елемент має своє латинська назва і хімічний символ, що складається з однієї або пари латинських букв, регламентовані ІЮПАК і наводяться, зокрема, в таблиці Періодичної системи елементів Менделєєва [2].
Формою існування хімічних елементів у вільному вигляді є прості речовини (одноелементні) [3]. Необхідно розрізняти хімічні елементи (абстрактні об'єкти, що описуються через свої характеристики) і відповідні їм матеріальні об'єкти - прості речовини (що володіють певними фізико-хімічними властивостями) [4].
Історія становлення поняття [| ]
Слово «елемент» (лат. Elementum) використовувалося ще в античності (Цицероном. Овідієм. Горацием) як частина чогось (елемент мови, елемент освіти і т. П.). У давнину була поширена вислів «Як слова складаються з букв, так і тіла - з елементів». Звідси - ймовірне походження цього слова: за назвою ряду приголосних букв в латинському алфавіті: l, m, n, t ( «el» - «em» - «en» - «tum»). [6]
Близьке до сучасного розуміння поняття хімічного елемента відображала нова система хімічної філософії, викладена Робертом Бойл в книзі «Хімік-скептик» (одна тисяча шістсот шістьдесят-один). Бойль вказав, що ні чотири стихії Аристотеля, ні три принципу алхіміків не можуть бути визнані в якості елементів. Елементи, згідно Бойлю - практично нерозкладних тіла (речовини), що складаються з подібних однорідних (що складаються з первоматерии) корпускул. з яких складені всі складні тіла і на які вони можуть бути розкладені. Корпускули можуть відрізнятися формою, розміром, масою. Корпускули, з яких утворені тіла, залишаються незмінними при перетвореннях останніх [7].
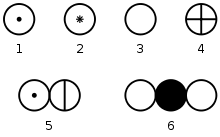
Символи хімічних елементів по Дж. Дальтон: 1 - водень; 2 - магній; 3 - кисень; 4 - сірка; 5 - аміак; 6 - діоксид вуглецю.
Завдяки Джону Дальтону на початку XIX ст. в хімії взяла гору атомно-молекулярна гіпотеза. розглядає хімічний елемент як окремий вид атомів і вказує на природу простих і складних речовин, як складаються, відповідно, з атомів одного або різного видів. Дальтон же вперше вказує на атомний вага як найважливіша властивість елементів, що визначає його хімічну природу. Завдяки зусиллям Йёнса Берцелиуса і його послідовників були вельми точно визначені атомні ваги (атомні маси) відомих елементів. Середина XIX в. ознаменувалася цілим рядом відкриттів нових елементів. На міжнародному з'їзді хіміків у м Карлсруе в 1860 р було прийнято визначення понять молекули й атома.
На час відкриття Періодичного закону Д. І. Менделєєвим (1869) було відомо 63 елемента. Саме атомний вага була виділена їм як властивість атомів, що визначає періодичний характер зміни властивостей хімічних елементів. а також утворених ними простих і складних речовин. Менделєєв визначав хімічні елементи як «матеріальні частини простих або складних тіл, які надають їм відому сукупність фізичних і хімічних властивостей». Відкриття Менделєєва дозволило передбачити існування, а також властивості ряду невідомих тоді елементів і послужило науковою основою для їх класифікації.
Однак Менделєєв був змушений зробити кілька перестановок в послідовності елементів, розподіленої по зростаючій атомній вазі, щоб дотримати періодичність хімічних властивостей, а також ввести незаповнені клітини, що відповідають невідкритим елементам. Пізніше (в перші десятиліття XX століття) стало ясно, що періодичність хімічних властивостей залежить від атомного номера (заряду атомного ядра), а не від атомної маси елемента. Остання визначається кількістю стабільних ізотопів елемента і їх природного поширеністю. Проте, стійкі ізотопи елемента мають атомні маси, що групуються біля деякого значення, оскільки ізотопи з надлишком або недоліком нейтронів в ядрі нестабільні, причому з ростом числа протонів (тобто атомного номера) число нейтронів, що формують в сукупності стабільне ядро, також зростає. Тому періодичний закон може бути сформульований і як залежність хімічних властивостей від атомної маси, хоча ця залежність порушується в кількох випадках.
З відкриттям ізотопів стало ясно, що навіть різні сукупності атомів одного і того ж елемента можуть мати розрізняються атомні маси; так, радіогенний гелій, виділений з уранових мінералів, в зв'язку з переважанням ізотопу 4 He має атомну масу більше, ніж гелій космічних променів (де присутня також легкий ізотоп 3 He).
Сучасне розуміння хімічного елемента як сукупності атомів, що характеризуються однаковим позитивним зарядом ядра. рівним номеру елемента в Періодичної таблиці, з'явилося завдяки фундаментальним роботам Генрі Мозлі (1915) і Джеймса Чедвіка (1920) [9].
Відомі хімічні елементи [| ]
Синтез нових (не виявлених в природі) елементів, що мають атомний номер вище, ніж у урану (трансуранових елементів), здійснювався спочатку за допомогою багаторазового захоплення нейтронів ядрами урану в умовах інтенсивного нейтронного потоку в ядерних реакторах і ще більш інтенсивного - в умовах ядерного (термоядерного ) вибуху. Подальша ланцюжок бета-розпадів нейтроноізбиточних ядер призводить до зростання атомного номера і появи дочірніх ядер з атомним номером Z> 92. Таким чином були відкриті нептуній (Z = 93), плутоній (94), америцій (95), берклій (97), ейнштейній (99) і фермій (100). Кюрій (96) і калифорний (98) також можуть бути синтезовані (і практично виходять) цим шляхом, проте відкриті вони були спочатку за допомогою опромінення плутонію і кюрія альфа-частками на прискорювачі. Більш важкі елементи, починаючи з Менделевий (101), виходять тільки на прискорювачах, при опроміненні актіноідних мішеней легкими іонами.
Право запропонувати назву нового хімічного елементу надається першовідкривачам. Однак ця назва має задовольняти певним правилам. Повідомлення про нове відкриття перевіряється протягом декількох років незалежними лабораторіями, і, в разі підтвердження, Міжнародний союз теоретичної і прикладної хімії (ІЮПАК, IUPAC, en: International Union for Pure and Applied Chemistry) офіційно стверджує назва нового елемента.
Невідкриті або незатвердженим елементи часто називаються за допомогою системи, використаної ще Менделєєвим, - за назвою вищого гомолога в періодичній таблиці, з додаванням префіксів «ека-» або (рідко) «дви-», що означають санскритські числівники «один» і «два» ( в залежності від того, на 1 або 2 періоду вище знаходиться гомолог). Наприклад, до відкриття германій (стоїть в періодичній таблиці під кремнієм і передвіщений Менделєєвим) називався ека-кремнієм, унуноктій (118) називається також ека-радоном. а флеровій (унунквадій, 114) - ека-свинцем.
Класифікація [| ]
Поширеність хімічних елементів у земній корі (% мас.) - кларкового числа
Освіта [| ]
Більшість хімічних елементів (94 з відомих 118) були знайдені в природі (в земній корі), хоча деякі з них були спочатку отримані штучно (а саме: технецій Tc (порядковий номер 43), прометій Pm (61), астат At (85) , а також трансуранові нептуний Np (93) і плутоній Pu (94); ці п'ять елементів після їх штучного створення були в зникаюче малих кількостях виявлені і в природі, вони виникають як проміжні ядра при радіоактивному розпаді урану і торію, а також при захопленні ураном нейтронів і подальшому бета-розпад). Таким чином, в земній корі є в наявності (в дуже різних концентраціях) все перші 94 елемента таблиці Менделєєва.
Серед цих 94 хімічних елементів, виявлених в земній корі, більшість (83) є первинними, або прімордіальние; вони виникли при нуклеосинтезі в Галактиці до утворення Сонячної системи. і у цих елементів є ізотопи, які є або стабільними, або досить довгоживучими, щоб не розпастися за минулі з цього моменту 4,567 мільярда років. Решта 11 природних елементів (технецій. Прометий. Полоній. Астат. Радон. Франций. Радій. Актиній. Протактиний. Нептуний і плутоній) є радіогенний - вони не мають настільки довгоживучих ізотопів, тому всі існуючі в земній корі природні атоми цих елементів виникли при радіоактивному розпаді інших елементів [12] [13].
Всі елементи, такі після плутонію Pu (порядковий номер 94) в періодичній системі Д. І. Менделєєва. в земній корі повністю відсутні [14]. хоча деякі з них можуть утворюватися в космосі під час вибухів наднових [джерело не вказано тисяча п'ятсот сорок-один день]. Періоди напіврозпаду всіх відомих ізотопів цих елементів малі в порівнянні з часом існування Землі. Багаторічні пошуки гіпотетичних природних надважких елементів поки не дали результатів.
Більшість хімічних елементів, крім кількох найлегших, виникли у Всесвіті головним чином в ході зоряного нуклеосинтезу (елементи до заліза - в результаті термоядерного синтезу, більш важкі елементи - при послідовному захопленні нейтронів ядрами атомів і подальшому бета-розпад. А також в ряді інших ядерних реакцій). Найлегші елементи (водень і гелій - майже повністю, літій. Берилій і бор - частково) утворилися в перші три хвилини після Великого вибуху (первинний нуклеосинтез).
Одним з головних джерел особливо важких елементів у Всесвіті повинні бути, згідно з розрахунками, злиття нейтронних зірок. з викидом значної кількості цих елементів, які згодом беруть участь в утворенні нових зірок і їх планет. [15]
Хімічні елементи як складова частина хімічних речовин [| ]
Хімічні елементи утворюють близько 500 простих речовин [16]. Здатність одного елемента існувати у вигляді різних простих речовин, що відрізняються за властивостями, називається аллотропией. [16] У більшості випадків назви простих речовин збігаються з назвою відповідних елементів (наприклад, цинк, алюміній, хлор), проте в разі існування декількох аллотропних модифікацій назви простого речовини і елемента можуть відрізнятися, наприклад кисень (дікіслород, O2) і озон (O3 ); алмаз. графіт і ряд інших аллотропних модифікацій вуглецю існують поряд з аморфними формами вуглецю.