Інтерес до # xa0; хімічним коливань визначається надією зрозуміти механізм біологічних періодичних процесів.
Проблема полягає в # xa0; тому, що на сьогоднішній день ми не маємо жодної задовільної математичної моделі для цих коливань, експериментально вивчених досить добре.
Мета цієї роботи # xa0; - деталізувати механізм гомогенної автоколебательной хімічної реакції Бєлоусова-Жаботинського (далі Б-Ж) в # xa0; циліндричному склянці і # xa0; чашці Петрі. Для досягнення поставленої мети були вивчені теоретичні основи автоколивальних хімічних реакцій; проведені реакції Б-Ж в # xa0; циліндричному склянці і # xa0; чашці Петрі; вивчений механізм автоколебательной реакції Б-Ж, побудована схема автоколебательной реакції Б-Ж.
Універсальність нелінійної динаміки робить важливим вдалий вибір лабораторної системи, в # xa0; якою можна вивчати структуроутворення (самоорганізацію). До # xa0; таким лабораторним системам належить гомогенна автоколивальна хімічна реакція, відкрита # xa0; Б. # xa0; П. # xa0; Білоусовим та # xa0; надалі вивчена # xa0; А. # xa0; М. # xa0; Жаботинським і # xa0; іншими вченими.
Реакція Бєлоусова-Жаботинського # xa0; - це протікає в # xa0; автоколивальних режимі каталітичне окислення відновників бромноватой кислотою НВrO3. При цьому спостерігаються коливання концентрацій окисленої і # xa0; відновленої форм каталізатора і # xa0; деяких проміжних продуктів. Реакція йде в # xa0; кислотному середовищі (H2SO4), в # xa0; як каталізатори іони церію змінного ступеня окислення Ce (SO4) 2: Ce3 + і # xa0; Ce4 +. В # xa0; ролі відновника виступає лимонна кислота ((HOOC) C (OH) (CH2COOH) 2).
Для проведення експерименту використовувалися реактиви:
# xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; 160 мг розчину лимонної кислоти (HOOC) C (OH) (CH2COOH) 2 # xa0; - відновник;
# xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; 3 мг сірчаної кислоти (H2SO4) # xa0; - для створення кислого середовища;
# xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; 16г бромата калію (KBrO3) # xa0; - неорганічна сполука, сіль лужного металу калію і # xa0; бромноватой кислоти, безбарвні кристали, добре розчинні у # xa0; воді, є сильним окислювачем, може бути використаний в # xa0; як розпушувач тіста ( в деяких країнах заборонено) # xa0; - харчова добавка Е924а; бромат калію термічно нестійкий, розкладається без плавлення, утворюючи бромід і # xa0; кисень. Реагує з # xa0; сірчаною кислотою;
# xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; 3,5 г сульфату церію (Ce (SO4) 2) # xa0; - порошок білого кольору, безводна сіль. Іон сульфату церію [Ce (SO4) 24+] є сильним окислювачем, особливо в # xa0; кислому середовищі. Сульфат церію застосовується як каталізатор.
Експеримент проходив так: на електронних вагах були відміряно 16 г # xa0; бромата калію (KBrO3) і 3,5 г # xa0; сульфату церію (Ce (SO4) 2). Підготовлено розчин сірчаної кислоти H2SO4 в # xa0; співвідношенні 1/3 частинах дистильованої води, розчин лимонної кислоти: в # xa0; стакан додали 60 г # xa0; лимонної кислоти, змішали з 100 мл дистильованої води. Потім в # xa0; колбі були змішані бромат калію і # xa0; сульфат церію з # xa0; кислотами (рис. 1).

Мал. 1. Підготовка розчинів лимонної (HOOC) C (OH) (CH2COOH) 2 (ліворуч) і # xa0; сірчаної H2SO4 (в центрі) кислот, змішування реактивів з # xa0; кислотами (праворуч)
- # Xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; Деталізація гомогенної автоколебательной реакції Б-Ж в # xa0; циліндричному склянці
В експериментах в # xa0; циліндричному склянці зафіксовано періодична зміна по спектральному випускання забарвлення розчину від молочного (максимальна концентрація [Ce + 3]) до # xa0; темно-помаранчевого (максимальна концентрація [Ce + 4]) і # xa0, зворотно, викликане коливаннями концентрацій окисленої і # xa0; відновленої форм каталізатора Ce (SO4) 2 і # xa0; проміжних продуктів [Br-] (рис.2):

Мал. 2. Стадії реакції Бєлоусова-Жаботинського (наведені середні значення):
1 # xa0; - жовта (довжина хвилі, λ = 580 нм; частота, f = 520 ТГц; енергія фотонів, Е = 2,15 еВ),
2-світло помаранчева (довжина хвилі, λ = 590 нм; частота, f = 510 ТГц; енергія, Е = 2,10 еВ),
3 # xa0; - помаранчева (довжина хвилі, λ = 620 нм; частота, f = 490 ТГц; енергія фотонів, Е = 1,98 еВ),
4 # xa0; - червона (довжина хвилі, λ = 750 нм; частота, f = 410 ТГц; енергія фотонів, Е = 1,68 еВ)
Перехід від стадії 1 до # xa0; стадії 3 супроводжується появою біфуркацій # xa0; - змінюється усталений режим роботи системи в # xa0; окремих точках біфуркації # xa0; - точках критичного стану системи, в # xa0; яких система стає нестійкою щодо флуктуацій і # xa0; виникає невизначеність: чи стане стан системи хаотичним або вона перейде на новий, більш диференційований і # xa0; високий рівень впорядкованості. Поки компоненти реакції не витрачені такий перехід відбувається. Стохастичность в # xa0; даному випадку міститься в # xa0; ймовірності появи точок біфуркації.
Видимий хімічна реакція є екзотермічної, супроводжується виділенням теплоти, внаслідок розриву зв'язків, утворення зв'язків продуктів реакції, що відбивається на спектральному випущенні забарвлення розчину, а # xa0; саме енергія фотонів зменшується від 2,15еВ до 1,68 еВ.
Період коливань Т # Xa0; чітко ділиться на дві частини: Т1 # Xa0; - фаза окислення каталізатора або фаза наростання концентрації [Се4 +], стадії 1 -3 -4. і # xa0; Т2 # Xa0; - фаза відновлення каталізатора або фаза падіння концентрації [Се4 +], стадії 4 -2 -1. був проведений з # xa0; допомогою експериментальних даних. Відзначимо, що Т # Xa0; зменшувався з часом: від 1,5 до 0,6 хвилини (ріс.3-4). Після того, як всі компоненти реакції були витрачені, реакція припинилася.
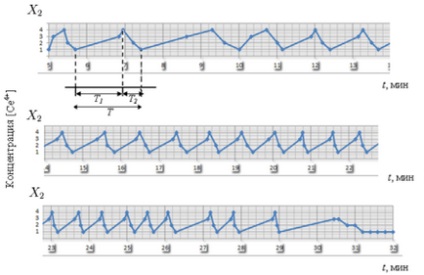
Мал. 3. Період коливань Т # Xa0; реакції Б-Ж, який ділиться на дві частини: Т1 # Xa0; - фаза наростання [Се4 +] і # xa0; Т2 # Xa0; - фаза падіння [Се4 +]
Отриманий графік демонструє експонентний характер зміни концентрації каталізатора.
Отримана закономірність задовольняє моделі Лотки # xa0; - Вольтерри, в # xa0; якій концентрація С # Xa0; змінюється експоненціально, а # xa0; концентрація [Br -] # xa0; - лінійно:
де: концентрація автокатализаторов [Се3 +];
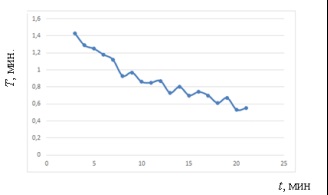
Мал. 4. Зміна періоду Т # Xa0; протягом усього експерименту
Графік зміни періоду Т # Xa0; демонструє виявлену закономірність # xa0; - нерівномірне зменшення періоду протягом усього експерименту.
Схематично зобразимо механізм гомогенної автоколебательной реакції Б-Ж в # xa0; циліндричному склянці (рис.5):
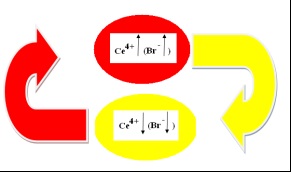
Мал. 5. Механізм реакції гомогенної автоколебательной Б-Ж
На першій стадії реакції (червоний овал, Т1) [Се3 +] окислюється броматом. Концентрація [Се4 +] зростає:
При досягненні верхнього граничного значення за концентрацією [Се4 +], концентрація (інгібітора) різко зростає, що призводить до # xa0; гальмування реакції. [] Взаємодіє з # xa0; активними частинками реакції і # xa0; з деякою швидкістю зникає з системи, що сприяє зменшенню концентрації [Се4 +].
Концентрація [Се4 +] зменшується (жовтий овал), досягає нижнього порогового значення, при цьому концентрація [] падає. Раз концентрація сповільнювач [] впала, реакція починається з # xa0; великою швидкістю: чотиривалентний церій відновлюється лимонної (HOOC) C (OH) (CH2COOH) 2 кислотою:
Після цього цикл повторюється. Таким чином, нами виявлено «годинник» реакції: [].
Недоліком запропонованої схеми є те, що, по-перше, вона не містить в # xa0; собі всі хімічні процеси, а # xa0; виділяє тільки два основних, і # xa0, по-друге, не містить математичну модель закономірності автоколебаний.
Для проведення експерименту в # xa0; чашці Петрі був використаний розчин, приготований в # xa0; попередньому експерименті, який був розміщений тонким шаром.
Спостерігається автоволнових процес, що виник внаслідок розсіювання концентрації каталізатора на неоднорідностях поверхні.
Даний автоволнових процес характеризується просторовими і # xa0; тимчасовими розмірами, незалежними від початкових умов і # xa0; геометричних розмірів системи.
Також ми спостерігаємо зміну спектрального випускання від жовтого до # xa0; помаранчевого, викликаного коливаннями концентрацій каталізатора Ce (SO4) 2 і # xa0; проміжних продуктів від жовтого до помаранчевого (рис.6). Зміна концентрацій [Се3 +] і [Се4 +] не відбувається синхронно у всьому розчині внаслідок расфазіровкі коливань в # xa0; окремих точках розчину, максимуми виникають нерівномірно в # xa0; різних частинах розчину.
Таким чином, ми спостерігаємо періодичні біжать хвилі окислення, які виходять із неоднорідності (ділянки з # xa0; зміненими параметрами). Швидкість поширення хвиль окислення постійна і # xa0; визначається властивостями простору, а # xa0; період проходження # xa0; - параметрами в # xa0; ділянці неоднорідності.
Мал. 6. Зміна структур з автохвиль в # xa0; реакції Б-Ж в # xa0; чашці Петрі
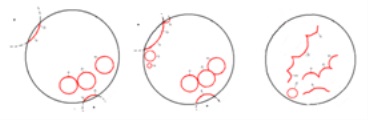
Мал. 7. Схематичне зображення зміна фронтів
При цьому має місце синхронізація середовища внаслідок локального підвищення кислотності або концентрації бромата. Позначимо А # xa0; і В # xa0; - підвищення кислотності (А) і # xa0; підвищення концентрації бромата (В); С # xa0; - точка першого зіткнення хвиль від А # xa0; і В; D # xa0; - захоплення У # xa0; хвилями, що виходять із А; F # xa0; - повне зникнення синфазних коливань (рис.8).
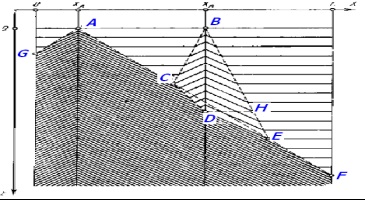
Мал. 8. Синхронізація середовища: поглинання однієї хвилі іншу
Після того, як концентрація компонентів реакції, а # xa0; саме, концентрація виявлених «годин» реакції: [], була витрачена, реакція припиняється.
Таким чином, незважаючи на різні умови протікання експерименту в # xa0; циліндричному склянці і # xa0; чашці Петрі: в # xa0; першому випадку причиною початку процесу самоорганізації служать біфуркації, у другому # xa0; - розсіювання концентрації каталізатора на неоднорідностях поверхні, в # xa0; обох випадках виявлені «годинник» реакцій: [] # xa0; - іони брому, наявність необхідної величини якого є головним, але не єдиною умовою запуску самоорганізації. В # xa0; системі лотків «мисливець-жертва» цими «годинами» є корм для жертви: якщо корми буде мало # xa0; - вівці помруть, помруть і # xa0; вовки. Якщо корму буде дуже багато # xa0; - вовки перенаситив, перестануть полювати, в # xa0; їхню зграю поміняються закони ієрархії ... Т. # xa0; е. в наявності універсальність закономірностей самоорганізації!
Основні терміни (генеруються автоматично). склянці і чашці Петрі, в циліндричному склянці і чашці, реакції Б-Ж, автоколебательной реакції Б-Ж, сульфату церію, концентрації каталізатора, компоненти реакції, хімічна реакція, лимонної кислоти, фаза окислення каталізатора, реакції Б-Ж в циліндричному, калію і сульфат церію, механізм автоколебательной реакції, Т1 - фаза, і Т2 - фаза, бромат калію, фаза наростання, фаза падіння, фаза наростання концентрації, фаза падіння концентрації.