2 [Р] + 8 [О] + 3Feж = (3FeOP2O5)
величина константи рівноваги може бути обчислена за формулою
Розрахунки по цій реакції показують, що окислення фосфору в обсязі металу можливо лише при низькій температурі і малому вмісті вуглецю в стали.
Окислення розчиненого в металі фосфору може відбуватися за таких реакцій:
Однак P2O5 термічно нестійка і при температурах сталеплавильних процесів у вільному стані існувати не може.
У кисневому конвертері при низьких температурах початку плавки можуть утворитися фосфати заліза
(P2O5) + 3 (FeO) = (3FeO * P2O5).
Фосфати заліза також нестійкі при температурах кінця плавки, тому для успішного видалення фосфору в шлак необхідно утворення міцного з'єднання P2O5. Практикою встановлено, що основна дефосфорірующая роль належить CaO, яка в шлаку утворює такі сполуки:
3 (СаО) + (P2O5) = (3СаО * P2O5)
4 (СаО) + (P2O5) = (4СаО * P2O5)
Комбінуючи останнє рівняння з рівнянням (3.47), отримаємо рівняння сумарної реакції дефосфорации:
Окислення фосфору можливо тільки на міжфазної поверхні метал - шлак в присутності вапняно-залізистого шлаку.
Необхідною умовою дефосфорации є наявність в шлаку достатньої кількості вільної CaO, так як міцний зв'язок CaO з P2O5 може бути порушена присутністю вільної SiO2, що має більшу спорідненість до CaO.
За даними Вінклера і Чіпмен,
У цьому рівнянні активності оксидів і тетрафосфат кальцію виражені в мольних частках. Числове значення Kp різко зменшується з підвищенням температури.
Згідно зі слів (3.49) при рівновазі металу зі шлаком знаходимо значення коефіцієнта розподілу фосфору
Таким чином, можна сформулювати умови, дотримання яких дозволяє видаляти фосфор з металу:
1) окислювальна среда, висока активність FeO;
2) висока основність шлаку;
3) зменшення а (4СаO * P2O5) або а (P2O5) шляхом зміни (скачування) шлаку;
4) невисока температура.
Розглянемо докладніше вплив перерахованих параметрів на видалення фосфору.
Фактори, що сприяють видаленню фосфору з металу
Термодинамічні дані не завжди можуть бути використані для розрахунків повноти протікання процесу дефосфорации через складність визначення закономірностей зміни активностей P2O5 і CaO, тому часто доводиться обмежуватися виробничими даними, приймаючи за показник дефосфорации металу Lp = (Р2О5) / [P].
Вплив (FeO). Виходячи з іонної теорії будови шлакових розплавів, окислення фосфору залізистим шлаком можна описати рівнянням:
[Р] + 4 (О2) + 2,5 (Fe2 +) = (PO4в3-) + 2,5Fe.
При відсутності іонів О2- і Fe2 + (FeO) → Про; дефосфорация металу виключається, так як не може розвиватися перша основна реакція - утворення P2O5.
Крім зазначеного прямого впливу, FeO надає непрямий позитивний вплив завдяки прискоренню розчинення вапна в шлаку.
Збільшення активності (FeO) на практиці досягається присадками твердих окислювачів (руди, агломерату) або продувкою ванни при підвищеному положенні фурми.
Температурна залежність Lp між металом і залозистим шлаком описується рівнянням
Розрахунки за цим рівнянням показують, що при температурі металу 1550-1750 ° С Lp = 0,1-0,4, тобто залізисті шлаки, що складаються тільки з оксидів заліза, не забезпечують помітну дефосфорацию.
Вплив основності шлаку. З підвищенням основності Lp зростає за умови, якщо не утворюється малоактивний гетерогенний шлак.
На рис. 3.28 показана залежність відносини (Р2О5) / [Р] від змісту (FeO) в шлаку (а) і від величини (CaO / FeO) (б).
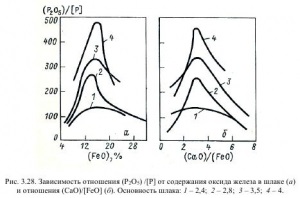
Дані малюнка свідчать про те, що існують оптимальні значення змісту (FeO), складові 14-18%, і відносини (CaO) / (FeO), рівні 2,5-3,0. По ходу плавки значення Lp коливаються в межах 50-500.
Підвищення основності шлаку домагаються за рахунок присадок вапна і матеріалів, що забезпечують її розчинення.
Вплив температури ванни. Підвищення температури термодинамічно сприяє зменшенню Lp, тобто погіршує перехід фосфору з металу в шлак, але поряд з цим воно прискорює розчинення вапна і призводить до підвищення а (СаО), що діє в бік посилення процесу дефосфорации. Підвищення температури знижує в'язкість шлаку і тим прискорює процес видалення фосфору. В цілому, якщо вміло використовувати температурний фактор для отримання гомогенних високоосновних шлаків, при високій температурі другої половини плавки можна забезпечити не менш успішну дефосфорацию металу, ніж в її першій половині. За інших рівних умов найбільш ефективно дефосфорация йде при деякій оптимальній температурі 1450-1550 ° С.
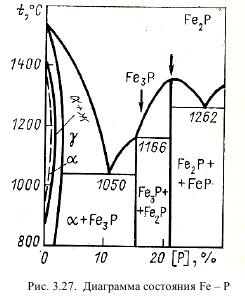
Поведінка фосфору по ходу плавки
Однією з причин створення киснево-конвертерного процесу послужила проблема видалення фосфору в умовах металургійних агрегатів високої продуктивності. Отримання низьких концентрацій цього елементу в основних конвертерах з донним дуттям незалежно від складу останнього пов'язано з необхідністю Передув, що негативно впливає на якість сталі. На рис. 3.29 показані характерні криві зміни вмісту фосфору по ходу продувки в томасівському і LD-конвертерах.
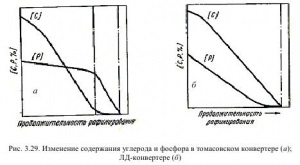
Особливістю рафінування в томасівському конвертері є повне вигоряння вуглецю незалежно від того, переважно воно чи ні, тобто інтенсивне видалення фосфору відбувається тільки в третьому періоді продувки (рис. 3.29, а); на відміну від цього, в LD-конвертері окислення фосфору прогресує при високому вмісті вуглецю, що дозволяє закінчувати продування при заданому його утриманні (рис. 3.29, б).
Протягом значної частини конвертерної плавки розподіл фосфору між металом і шлаком зазвичай близько до рівноважного, хоча, як правило, його не досягає. У зв'язку з цим поведінка фосфору по ходу продувки в основному визначається зміною умов рівноваги реакції (3.48), тобто зміною температури ванни і складу шлаку. При наявності в'язкого шлаку, недостатньому перемішуванні ванни дійсне розподіл фосфору між фазами може істотно відхилятися від рівноважного.
На початку плавки з огляду на низьку температури і високий вміст оксидів заліза в шлаку фосфор успішно окислюється і переходить в шлак навіть при низькій його основності. Під час продування зверху є можливість регулювати окисленность шлаку шляхом зміни дутьевого режиму. Ведення продувки в перші хвилини при підвищеному положенні фурми сприяє швидкому формуванню активного вапняно-залізистого шлаку, здатного екстрагувати фосфор на ранній стадії плавки.
З ростом a (FeO) в первинному шлаку дефосфорация все більш випереджає обезуглероживание і збільшується відношення Д [Р] / Д [З].
В середині продувки в зв'язку з ростом температури, зниженням окислення шлаку і слабким зростанням його основності окислення фосфору може сповільнюватися.
В кінці плавки, особливо на низкоуглеродистую сталь, збільшуються основність, окисленность і жідкоподвіжность шлаку, що сприяє видаленню фосфору.
Розглядаючи питання, пов'язані з видаленням фосфору, не можна забувати про кінетику процесу. Відомо, що лімітуючим ланкою процесу є дифузія фосфору в шлаку.
Швидкість дифузії фосфору з прикордонного шару в об'єм шлакової фази описується рівнянням першого порядку
де РШ - кількість фосфору в шихті,%;
0,43 - коефіцієнт перерахунку P2O5 на фосфор; qшл - кількість шлаку,%
Lp - коефіцієнт розподіл фосфору, Lp = (Р2О5) / [Р].
Розрахунки по цій формулі і практичні результати свідчать про те, що в кисневих конвертерах досягається високий ступінь видалення фосфору з металу; ступінь дефосфорации становить 90% і більше. При роботі зі скачуванням шлаку цей показник становить 98-99%, однак ця операція подовжує цикл плавки і викликає додаткові втрати заліза і тепла.
Поведінка фосфору в процесі випуску плавки
У практичній роботі можна залишати поза увагою можливість переходу фосфору з шлаку в метал (рефосфорація). Готову плавку випускають в ківш; разом з металом в ківш потрапляє конвертерний шлак, який взаємодіє з футеровкою ковша. Якщо футеровка ковша виконана з шамоту, що складається з SiO2 і А12О3, то основностьшлаку починає постійно зменшуватися. Раскислители, що вводяться в ківш, можуть відновлювати частина фосфору з шлаку в метал