Культури клітин вищих рослин
Методики культивування одиночних рослинних клітин
Окремі клітини культивують для одержання клонів, вивчення їх генетичної та фізіологічної мінливості або стабільності. Крім того, культивування окремих клітин дозволяє вивчати умови, що визначають виникнення стимулів до поділу у клітин, ізольованих від впливу інших клітин популяції або тканини. Окремі клітини також важливі для клоновій селекції мутантних, гібридних і трансформованих ліній. Зазвичай в такі клітини вводять маркерні гени, які дозволяють здійснювати селекцію.
Крім того, окремі клітини можуть служити моделлю для порівняльного вивчення фізіологічних процесів в тканини і ізольованою клітці. Наприклад, для вивчення фотодихання можна порівнювати процес фотосинтезу на рівні окремих клітин мезофіла листа і цілої тканини.
Вирощування ізольованих клітин складається з двох етапів: 1) ізолювання неушкодженою клітини рослинної або калусних тканини; 2) створення умов, сприятливих для зростання і розвитку ізольованої клітини.
На першому етапі необхідно виділити неушкоджену і життєздатну клітку з тканини цілого рослини або калусних тканини. Цього можна досягти шляхом обробки тканини Пектиназа, що веде до мацерації її клітин. Однак не завжди після такої обробки клітини зберігають здатність до подальших поділів і утворення тканини. Краще отримувати окремі клітини з суспензійних культур або пухкого каллуса. Ідеальними окремими клітинами є протопластів, які утворили клітинну стінку.
Далі клітини ізолюють або за допомогою мікроманіпуляторів, або шляхом ряду послідовних розведень. При перших же спробах культивування окремих клітин виникла важлива наукова проблема: як змусити ділитися клітини, ізольовані від впливу інших клітин популяції або тканин? Окремі клітини поводилися інакше, ніж їх скупчення у вигляді агрегатів в суспензії або калусних маси на поверхні живильного середовища.
При її вирішенні виникла гіпотеза про «факторі кондиціонування». Так було названо речовина, стимулююча поділ окремих клітин. Визначено, що цей фактор має хімічну природу, термолабилен, водорастворим, нізкомолекулярен (М.К. Павлова, Р.Г. Бутенко, 1965), відонеспеціфічен, не замінює відомі фітогормони, сінергічен з брасиностероїдів. Було запропоновано кілька варіантів культивування окремих клітин.
Вперше підібрати умови, які підходять для поділу окремих клітин, вдалося в 1954 році М'юїру, Хільденбранту і Райкер. Цей спосіб отримав назву методу «тканини - няньки» (рис. 12).
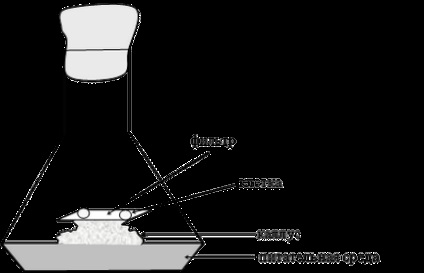
Мал. 12. Схема використання каллуса як «тканини - няньки»
Клітку ізолюють за допомогою мікроманіпулятора з пухкого каллуса безпосередньо на шматочок фільтра розміром 8 * 8 мм, поміщений на верхівку калусних тканини, з якої була взята клітина. Каллус повинен знаходиться в фазі активного зростання. Можна також в якості «няньки» використовувати калусних тканину іншої рослини спорідненого виду. В цьому випадку клітини ростуть і діляться. У міру старіння каллуса - няньки фільтр з клітинами переноситься на молодий каллус. Коли тканина з клітини досягає розмірів 0,5 - 1 мм, то її можна висаджувати безпосередньо на живильне середовище.
Проводилися також експерименти з висадження клітини безпосередньо на щільних середу, але обов'язково поряд з фільтром, який протягом декількох днів контактував з молодою, інтенсивно зростаючої калусних тканиною. Оскільки ці роботи показали, що постійний контакт клітини через фільтр з калусних масою не є обов'язковим для поділу клітини, то було запропоновано використовувати стару культуральне середовище для стимуляції одиночній клітини до поділу.
Можна також використовувати метод «годує шару». Для цього беруть суспензію клітин того ж виду, що й одиночна клітина, або близького виду. Клітинна суспензія повинна знаходитися в ранній експоненційної фазі ростового циклу. У 1959 році Бергман запропонував фільтрувати суспензійну культуру (в його експериментах це були тютюн і квасоля) стерильно через один шар батисту (осередку 0,3 * 0,1 мм). В результаті отримували суспензію, на 90% складається з окремих клітин. Цю суспензію змішували з агаризованому живильним середовищем того ж складу, що використовувався при культивуванні суспензії (середа містила 0,6% агару). Суміш розливали тонким шаром (1 мм) в чашки Петрі. Агар поділяв клітини, але не перешкоджав обміну хімічними сигналами між ними, а товщина шару дозволяла дивитися за їх поведінкою під мікроскопом.
Індукція поділів окремих клітин можлива при застосуванні дуже багатою живильного середовища, наприклад, середовища Као і Михайлюка. При цьому обсяг середовища, в яку поміщаються клітини, повинен був мінімальним (мікрокраплі об'ємом до 20 мкл).
Всі ці способи культивування дозволяють клітині «відчувати» фактор кондиціонування. Він або виробляється в достатній кількості клітинами «годує шару», «тканини - няньки», або міститься в суспензії, де раніше культивувалися клітини, або не втрачається у великому обсязі середовища. Таким чином, фактор, що викликає поділ клітин, виробляється самими клітинами, але в невеликій кількості. І тільки збільшуючи число клітин, що виробляють цей фактор, щоб він не розсіювався в великих обсягах живильного середовища, або ж зменшуючи обсяг середовища, в якому буде вирощуватися клітина, можна змусити її ділитися.
Інші розділи: