Для кожної з 20 амінокислот є відповідний фермент, званий аміноацил-т-РНК-лігази (АРСазой, або кодазой), який каталізує з'єднання певної амінокислоти з відповідною їй специфічної т-РНК (специфічність т-РНК визначається складом нуклеотидів антикодону в антикодоновой петлі т- РНК). Процес активації амінокислот називають терміном «рекогніція», тобто узнаваніе.Актівація амінокислот необхідна не тільки по тому, що тільки в активованому стані вони здатні до утворення пептидних зв'язків, а й тому, що амінокислоти самі по собі не здатні впізнавати кодони м-РНК (як було зазначено вище, цю роль виконують т-РНК ).
Активація амінокислот локалізована в цитоплазмі, здійснюється в дві стадії. На першій стадії амінокислота зв'язується в активному центрі кодази, специфічною до цієї амінокислоті, і реагує з АТФ, утворюючи високоенергетичний ангідрид - аміноаціладенілат (аа-аденилат). Наприклад, активацію пролина можна уявити такою спрощеною схемою:
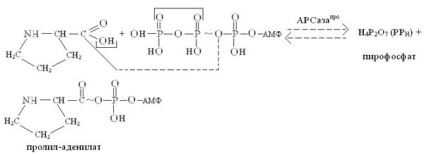
На другій стадії активоване залишок амінокислоти (в нашому випадку -залишок пролина) переноситься за рахунок енергії АТФ з аміноаціладенілата (аа) (в нашому випадку - з пролив-аденилат) на кінцеву 3'-ОН-групу кінцевого залишку рибози т-РНК аа ( у нас т-РНК про), в результаті утворюється складноефірний зв'язок між залишком амінокислоти і залишком рибози 3'-кінцевого залишку аденозину, що входить в послідовність нуклеотидів 3'-кінця т-РНК (-ЦЦА 3 '). Процес перенесення можна відобразити наступною схемою:
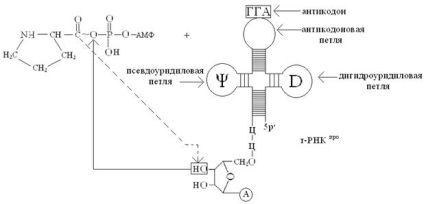
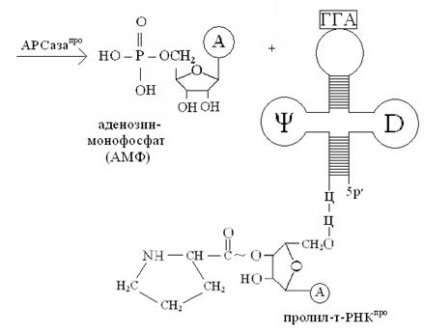
Зверніть увагу, що приєднання амінокислот до специфічним т-РНК супроводжується перенесенням енергії, яка використовується на утворення пептидних зв'язків (- CONH -) між амінокислотами в процесі біосинтезу білка на рибосомі!
Точність трансляції залежить від субстратної специфічності АРСаз як щодо т-РНК, так і відповідної їй амінокислоти. АРСази здатні розпізнавати і виправляти свої власні помилки. Наприклад, через те, що радикали амінокислот валіну і ізолейцину структурно дуже схожі один на одного, можна було очікувати, що на місце изолейцина в поліпептидний ланцюг буде часто вбудовуватися валін. Однак частота помилок при включенні структурно схожих амінокислот становить лише одну на 1300 амінокислотних залишків. АРСаза забезпечує негайне видалення помилково приєднаних амінокислотних залишків, каталізує гідроліз «неправильного» аміноаціладенілата:
ОАМФ + H2 O H2 N - CH - COOH + АМФ
Потім АРСаза мулі починає все спочатку і утворює правильний аа-аденилат: