13.Взаімодействіе металів з розчинами лугів.
13.Взаімодействіе металів з розчинами лугів. З водними розчинами лугів взаємодіють метали, що стоять у ряді напруг до водню і яким відповідають амфотерні оксиди. метали, відповідні амфотерним оксидів: Al, Cr, Zn, Be, Pb, Sn, Sb. 2Al + 2NaOH + 6H2 O = 2Na [Al (OH) 4] + 3H2 ↑
Взаємодія металів з розчинами лугів.
Метали, така їхня природа, не взаємодіють з атомами водню гідроксильної групи в молекулах підстав. Але на деякі з них діють розчини лугів. З лугами можуть взаємодіяти метали, що дають амфотерні гідроксиду або володіють високими ступенями окислення в присутності сильних окислювачів. При взаємодії металів з розчинами лугів, окислювачем є вода. Приклад. Zn + 2NaOH + 2H2 O = Na2 [Zn (OH) 4] + H2 ↑ (сторінка 122 в помічника) 1 Zn 0 + 4OH - - 2e = [Zn (OH) 4] 2 окислення Zn 0 - відновник 1 2H2 O + 2e = H2 + 2OH - відновлення H2 O - окислювач Zn + 4OH - + 2H2 O = [Zn (OH) 4] 2 + 2OH - + H2 ↑ Метали, що володіють високими ступенями окислення, можуть взаємодіяти з лугами при сплаву: 4Nb + 5O2 + 12KOH = 4K3 NbO4 + 6H2 O
14. Розрахунок складу суміші металів за кількістю газу, що виділився при реакції з лугом або кислотою.
14.Расчет складу суміші металів за кількістю газу, що виділився при реакції з лугом або кислотою. Для визначення змісту (мас.%) Цинку в партії технічного металу його зразок масою 800 мг обробили надлишком соляної кислоти. Обсяг (н.у.) виділився водню склав 262 мл.Вичісліть результат випробування зразка.
за рівнянням реакції 1моль · 22,4 л / моль H2 - 1 моль · 65 г / моль Zn
за умовою завдання 0,262 л Н2 - X г Zn
Приклад 1. При дії на суміш міді і заліза масою 20 г надлишком соляної кислоти виділилося 5,6 л газу (н.у.). Визначити масові частки металів у суміші.
У першому прикладі мідь не реагує з соляною кислотою, тобто водень виділяється при реакції кислоти з залізом. Таким чином, знаючи обсяг водню, ми відразу зможемо знайти кількість і масу заліза. І, відповідно, масові частки речовин в суміші.
Рішення прикладу 1.
Знаходимо кількість водню: n = V / Vm = 5,6 / 22,4 = 0,25 моль.
За рівняння реакції:
Кількість заліза теж 0,25 моль. Можна знайти його масу: mFe = 0,25 • 56 = 14 м
Тепер можна розрахувати масові частки металів у суміші: ωFe = mFe / mвсей суміші = 14/20 = 0,7 = 70%
Відповідь: 70% заліза, 30% міді.
При дії на суміш алюмінію і заліза масою 11 г надлишком соляної кислоти виділилося 8,96 л газу (н.у.). Визначити масові частки металів у суміші.
У другому прикладі в реакцію вступають обидва металу. Тут вже водень з кислоти виділяється в обох реакціях. Тому прямим розрахунком тут не можна скористатися. У таких випадках зручно вирішувати за допомогою дуже простої системи рівнянь, прийнявши за х- число моль одного з металів, а за у - кількість речовини другого.
Рішення прикладу 2.
Знаходимо кількість водню: n = V / Vm = 8,96 / 22,4 = 0,4 моль.
Нехай кількість алюмінію - х моль, а заліза у моль. Тоді можна висловити через х і у кількість виділився водню:
Число моль водню: nH2 = 3,36 / 22,4 = 0,15 моль, мольное співвідношення алюмінію і водню 2: 3 і, отже, nAl = 0,15 / 1,5 = 0,1 моль. Маса алюмінію: mAl = n • M = 0,1 • 27 = 2,7 г
Залишок - це залізо, масою 3 г. Можна знайти масу суміші: mсмесі = 16 + 2,7 + 3 = 21,7 м
Масові частки металів:
Відповідь: 73,73% міді, 12,44% алюмінію, 13,83% заліза.
Приклад 5.21,1 г суміші цинку і алюмінію розчинили в 565 мл розчину азотної кислоти, що містить 20 мас. % НNО3 має щільність 1,115 г / мл. Обсяг газу, що виділився, що є простим речовиною і єдиним продуктом відновлення азотної кислоти, склав 2,912 л (н.у.). Визначте склад отриманого розчину в масових відсотках. (РХТУ)
У тексті цього завдання чітко вказано продукт відновлення азоту - «проста речовина». Так як азотна кислота з металами не дає водню, то це - азот. Обидва металу розчинилися в кислоті. У задачі питається не склад вихідної суміші металів, а склад отриманого після реакцій розчину. Це робить задачу складнішою.
Рішення прикладу 5.
Визначаємо кількість речовини газу: nN2 = V / Vm = 2,912 / 22,4 = 0,13 моль.
Визначаємо масу розчину азотної кислоти, масу і кількість речовини розчиненої HNO3:
mраствора = ρ • V = 1,115 • 565 = 630,3 г mHNO3 = ω • mраствора = 0,2 • 630,3 = 126,06 г nHNO3 = m / M = 126,06 / 63 = 2 моль
Зверніть увагу, що так як метали повністю розчинилися, значить - кислоти точно вистачило (з водою ці метали не реагують). Відповідно, треба буде перевірити, чи не виявилася чи кислота в надлишку. і скільки її залишилося після реакції в отриманому розчині.
Складаємо рівняння реакцій (не забудьте про електронний баланс) і, для зручності розрахунків, приймаємо за 5х - кількість цинку, а за 10у - кількість алюмінію. Тоді, відповідно до коефіцієнтів в рівняннях, азоту в першій реакції вийде х моль, а в другій - 3у моль:
Наступне питання: чи залишилася в розчині азотна кислота і скільки її залишилося? За рівняннями реакцій, кількість кислоти, яка набрала в реакцію: nHNO3 = 0,48 + 1,08 = 1,56 моль, тобто кислота була в надлишку і можна обчислити її залишок у розчині: nHNO3 ост. = 2 - 1,56 = 0,44 моль.
Отже, в підсумковому розчині містяться:
нітрат цинку в кількості 0,2 моль: mZn (NO3) 2 = n • M = 0,2 • 189 = 37,8 г нітрат алюмінію в кількості 0,3 моль: mAl (NO3) 3 = n • M = 0, 3 • 213 = 63,9 г надлишок азотної кислоти в кількості 0,44 моль: mHNO3 ост. = N • M = 0,44 • 63 = 27,72 г
Яка маса підсумкового розчину? Згадаймо, що маса підсумкового розчину складається з тих компонентів, які ми змішували (розчини і речовини) мінус ті продукти реакції, які пішли з розчину (опади і гази):
Маса нового розчину
Сума мас змішуються розчинів і / або речовин
Тоді для нашої задачі:
mнов. розчину = маса розчину кислоти + маса сплаву металів - маса азоту mN2 = n • M = 28 • (0,03 + 0,09) = 3,36 г mнов. розчину = 630,3 + 21,1 - 3,36 = 648,04 г
Тепер можна розрахувати масові частки речовин в отриманому розчині:
Відповідь: 5,83% нітрату цинку, 9,86% нітрату алюмінію, 4,28% азотної кислоти.
Приклад 6.Прі обробці 17,4 г суміші міді, заліза і алюмінію надлишком концентрованої азотної кислоти виділилося 4,48 л газу (н.у.), а при дії на цю суміш такої ж маси надлишку соляної кислоти - 8,96 л газу (н.у.). Визначте склад вихідної суміші. (РХТУ)
При вирішенні цього завдання треба згадати, по-перше, що концентрована азотна кислота з неактивним металом (мідь) дає NO2. а залізо і алюміній з нею не реагують. Соляна кислота, навпаки, не реагує з міддю.
Відповідь до прикладу 6: 36,8% міді, 32,2% заліза, 31% алюмінію.
Гальванічний елемент - хімічне джерело електричного струму, заснований на взаємодії двох металів і (або) їх оксидів в електроліті, що приводить до виникнення в замкнутому ланцюзі електричного струму. Названий на честь Луїджі Гальвані.

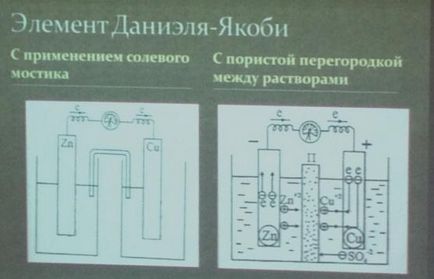

Типи гальванічних елементів: елементи з різнорідними електродами, концентраційні елементи, термогальваніческіе елементи.
Гальванічний елемент - це пристрій, що складається з 2 електродів, опущених в розчин електролітів і з'єднаних поза електроліту зовнішнім проводом; пристрій, що створює ЕРС в результаті протікання хім.реакцій на електродах.
Процеси перетворення хім.енергіі в електричну має місце в гальванічних елементах. Електрод, на якому протікає процес окислення, наз-ют анодом, його вважають негативним. Електрод, на якому протікає процес відновлення, наз-ют катодом, його вважають позитивним. Електрони виходять з елемента через анод і рухаються у зовнішній ланцюга до катода. Правила запису: ліворуч розташовується анод, праворуч - катод;

2.Процесс на електродах.
Дія будь-якого гальванічного елемента заснована на протіканні в ньому окислювально-відновної реакції. У найпростішому випадку гальванічний елемент складається з двох пластин або стрижнів, виготовлених з різних металів і занурених в розчин електроліту. Така система робить можливим просторове розділення окислювально-відновної реакції ': окислювання протікає на одному металі, а відновлення - • на іншому. Таким чином, електрони передаються від відновлювача до окислювача по зовнішньому ланцюзі.
Розглянемо як приклад мідно-цинковий гальванічний елемент, що працює за рахунок енергії наведеної вище реакції між цинком і сульфатом міді (рис. 82). Цей елемент (елемент Якобі - Даніеля) складається з мідної пластини, зануреної в розчин сульфату міді (мідний електрод), і цинкової пластини, зануреної в розчин сульфату цинку (цинковий електрод). Обидва розчину стикаються один з одним, але для попередження змішування вони розділені перегородкою, виготовленої з пористого матеріалу.
При роботі елемента, т. Е. При замкнутому ланцюзі, цинк окислюється: на поверхні його зіткнення з розчином атоми цинку перетворюються в іони і, гидратируясь, переходять в розчин. Вивільняються при цьому електрони рухаються по зовнішньому ланцюзі до мідного електрода. Вся сукупність цих процесів схематично зображується рівнянням полуреакции, або електрохімічним рівнянням:
На мідному електроді протікає відновлення іонів міді. Електрони, що приходять сюди від цинкового електрода, з'єднуються з вихідними з розчину дегідратірующая іонами міді; утворюються атоми міді, котрі виділяються як металу. Відповідне електрохімічне рівняння має вигляд:
Сумарне рівняння реакції, що протікає в елементі, вийде при додаванні рівнянь обох напівреакцій. Таким чином, при роботі гальванічного елемента електрони від відновника переходять до окислювача по зовнішньому ланцюзі, на електродах йдуть електрохімічні процеси, в розчині спостерігається спрямоване рух іонів.
Напрямок руху іонів в розчині обумовлено протікають у електродів електрохімічними процесами. Як уже сказано, у цинкового електрода катіони виходять в розчин, створюючи в ньому надлишковий позитивний заряд, а у мідного електрода розчин, навпаки, весь час збіднюється катіонами, так що; тут розчин заряджається негативно. В результаті цього створюється електричне поле, в якому катіони, що знаходяться в розчині (Сі 2+ і Zn 2 +), рухаються від цинкового електрода до мідного, а аніони -SO 2-в зворотному напрямку. В результаті рідина в обох електродів залишається електронейтральної. Схема руху електронів та іонів при роботі мідно-цинкового еле-мента показана на рис. 83.
Електрод, на якому протікає окислювання, називається а н о д о м. Електрод, на якому протікає відновлення, називається до а т о д о м. У мідно-цинковій елементі цинковий електрод є анодом, а мідний - катодом.
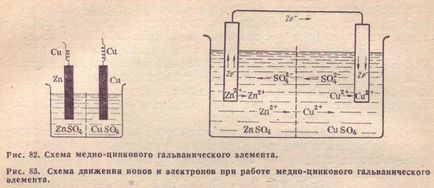
3. Роль пористої перегородки.
Слід вказати на роль пористої перегородки. Її призначення полягає лише в тому, щоб перешкодити не посередньо дії мідного купоросу на цинк. При безпосередньому дей ствии мідного купоросу на цинк енергія реакції виділилася б у вигляді теплоти в самому гальванічному елементі, замість того щоб перетворитися в електричний струм. У деяких конструкціях Гальве нических елементів пориста перегород ка не потрібна. Вона не була б потрібна і в розглянутому елементі Даніеля, якби застосовуваний в ньому цинк був ідеально чистий хімічно чистий цинк, як показує досвід, не взаємодіє з мідним купоросом при безпосередньому контакті. Скупчилися поблизу поверхні цинку в подвійному шарі позитивні іони цинку відштовхують однойменно заряджені іони міді і перешкоджають їх зіткненню з металевим цинком.
Поняття про електродному потенціал.
Якщо опустити металеву пластинку в воду, то поверхневі іони Me будуть взаємодіяти з полярними молекулами води. Полярні молекули води атакують пов-ть пластинки. В рез-ті в водне середовище переходять іони Ме, тому на кордоні розділу 2х фаз Ме / рідина утворюється подвійний електричний шар, що складається з іонів Ме і електронів надлишку металевої пластини. На кордоні Ме / розчин виникає подвійний електричний шар і встановлюється рівновага.
або не вмикаючи гідратаційну воду
Електродний потенціал металу - являє собою різницю потенціалів на межі метал-розчин. Їм визначається стан рівноваги електродного процесу. . Величина електродного потенціалу залежить від властивостей металу, концентрації іонів даного металу в розчині і температури. Ця залежність виражається ур-ем Нернста:
Для досить розбавлених розчинів.-Концентрація
R = 8.314 Дж К -1 моль -1 унів.газ.постоянная
F = 96487 Кл моль -1 число Фарадея
n - заряд іона металу.
- електродний потенціал.
Електродні потенціали вимірюють по відношенню до нормального водневого електрода. Водневий електрод являє собою пластину з губчастої пластини Pt, опущеною в розчин кислоти H2 SO4. через який пропускається газоподібний водень. Платина стосується металів високої хімічної стійкості. Газоподібний водень адсорбується на поверхні Pt. Для збільшення адсорбирующей здатності її покривають шаром губчастої платини. На поверхні платини, насиченої воднем, встановлюється рівновага:
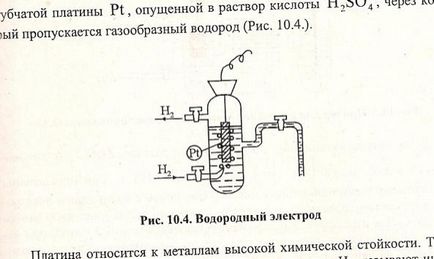
Н2 Абсолютне значення водневого електрода невідомо, але умовно вважають, що потенціал стандартного водневого електрода дорівнює нулю. = 0, коли = 101325 Па (760мм рт.ст.) Т = 298 К (25 ° С) [] = 1 моль / л