Сірка широко поширена в природі. Вона становить 0,05% маси земної кори. У вільному стані (самородна сірка) у великих кількостях зустрічається в Італії (острів Сицилія) і США. Родовища самородної сірки є в Куйбишевської області (Поволжя), в державах Середньої Азії, в Криму та інших районах.
Сірка часто зустрічається у вигляді сполук з іншими елементами. Найважливішими її природними сполуками є сульфіди металів: FeS2 - залізний колчедан, або пірит; HgS - кіновар та ін. А також солі сірчаної кислоти (кристалогідрати): CaSO4 ּ 2 H2O - гіпс, Na2SO4 ּ 10 H2O - глауберової сіль, MgSO4 ּ 7 H2O - гірка сіль і ін.
Фізичні властивості сірки
Природна сірка складається з суміші чотирьох стійких ізотопів:
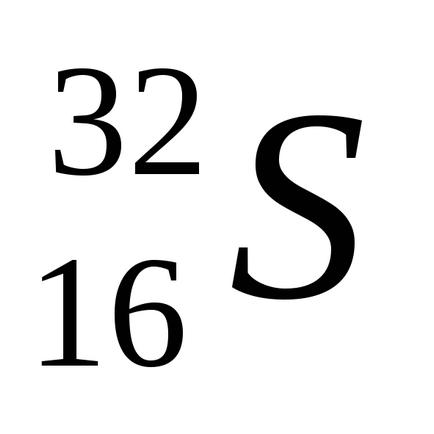

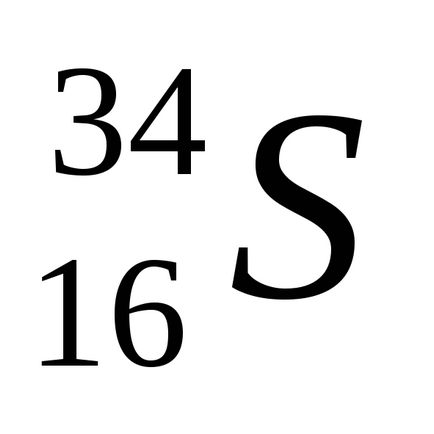
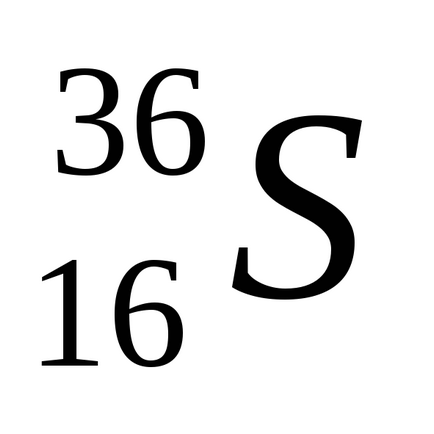
Сірка утворює кілька аллотропних модифікацій. Стійка при кімнатній температурі ромбическая сірка являє собою жовтий порошок, погано розчинний у воді, але добре розчинний в сероуглероде, аніліні і деяких інших розчинниках. Погано проводить теплоту і електрику. При кристалізації з хлороформаCHCl3 або з сероуглеродаCS2 вона виділяється у вигляді прозорих кристалів октаедричні форми. Ромбическая сірка складається з циклічних молекулS8. мають форму корони. При 113 0 Cона плавиться, перетворюючись на жовту легкорухливою рідиною. При подальшому нагріванні розплав загусає, тому що в ньому утворюються довгі полімерні ланцюжки. А якщо нагріти сірку до 444,6 0 С, вона закипає. Виливаючи киплячу сірку тонкою цівкою в холодну воду, можна получітьпластіческую сірку - резиноподібного модифікацію, що складається з полімерних ланцюжків. При повільному охолодженні розплаву утворюються темно-жовті голчасті крісталлимоноклінной сірки. (Tпл = 119 0 C). Подібно ромбічної сірки, ця модифікація складається з молекулS8. При кімнатній температурі пластична і моноклінна сірка нестійкі і мимоволі перетворюються в порошок ромбічної сірки.
Хімічні властивості сірки і її сполук
Властивості простої речовини.
Атом сірки, маючи незавершений зовнішній енергетичний рівень, може приєднувати два електрони і проявляти ступінь окислення -2. Таку ступінь окислення сірка виявляє в сполуках з металами і воднем (наприклад, Na2S іH2S). При віддачі або зволіканні електронів до атома більш електронегативного елемента ступінь окислення сірки може бути +2, +4 і +6.
Сірка легко утворює сполуки з багатьма елементами. При згорянні її на повітрі або в кисні утворюється оксид сірки (IV) SO2 і частково оксид сірки (VI) SO3:
2S + 3o2 = 2so3
Це найбільш важливі оксиди сірки.
При нагріванні сірка безпосередньо з'єднується з воднем, галогенами (крім йоду), фосфором, вугіллям, а також з усіма металами, крім золота, платини і іридію. наприклад:
3S + 2p = p2s3
2S + c = cs2
Як випливає з прикладів, в реакціях з металами і деякими неметалами сірка є окислювачем, в реакціях ж з більш активними неметалами, як наприклад, з киснем, хлором, - відновником.
Сірчистий газ SO2 - безбарвний газ з задушливим різким запахом. При розчиненні його у воді (при 0 0 С 1 об'єм води розчиняє більше 70 об'емовSO2) утворюється сірчиста кіслотаH2SO3. яка відома лише в розчинах.
У лабораторних умовах для отримання SO2 діють на твердий сульфіт натрію концентрованої сірчаної кислотою:
У промисловості SO2 одержують при випалюванні сульфідних руд, наприклад піриту: