Теорія хімічної будови
Хімічною будовою називається послідовність з'єднання атомів в молекулі і їх взаємне розташування в просторі. Зміна цієї послідовності призводить до утворення нової речовини з новими властивостями.
Основні положення теорії хімічної будови:
1. Властивості речовин визначаються його якісним і кількісним складом і хімічною будовою.
2. Атоми в молекулі соедініяются відповідно до їх валентністю.
3. Атоми і групи атомів в молекулі впливають один на одного, це вплив слабшає в міру їх взаємного видалення.
Теорія хімічної будови розроблена А.М. Бутлеровим і його учнями у другій половині XIX століття.
Хімічна зв'язок. Основні характеристики хімічного зв'язку
Хімічним зв'язком називають взаємодію, яке утримує атоми в молекулах і обумовлює стабільність молекул в певних умовах.
Основні характеристики хімічного зв'язку:
Енергія зв'язку (ЄСВ) - мінімальна енергія, необхідна для руйнування зв'язку.
Вимірюється в електронвольтах (еВ) для однієї зв'язку або в кДж / моль для одного благаючи зв'язків. Енергія зв'язку є характеристикою міцності зв'язку - чим вище енергія зв'язку, тим міцніше зв'язок.
Довжина зв'язку (LСВ) - відстань між ядрами пов'язаних атомів. Вимірюється в нанометрах (нм) або в ангстремах (А). Чим коротше зв'язок, тим вона, як правило, міцніше.
Насичуваність зв'язку - якщо атом утворює кінцеве число зв'язків з іншими атомами (зазвичай не більше 8) - зв'язок насичується, якщо нескінченно велика (більше 1000 чоловік) - ненасищаемості.
Спрямованість зв'язку - якщо в просторі існують певні напрямки, уздовж яких поширюється дія зв'язку, то зв'язок спрямована, якщо таких напрямків немає - то ненаправлена.
Енергія і довжина зв'язку характерні для будь-якої хімічної зв'язку, насичуваність і спрямованість залежать від виду зв'язку.
ковалентний зв'язок
Ковалентний зв'язок - зв'язок між атомами за рахунок загальних електронних пар.
При зближенні двох атомів водню можливо два випадки:
1. в міру зближення сили відштовхування між атомами необмежено зростають (крива 1), при цьому енергія системи збільшується і система не може бути стійкою.
2. сили відштовхування змінюються силами тяжіння, які досягають максимуму при відстані між ядрами, що дорівнює ro (крива 2), енергія системи в цьому стані мінімальна і менше сумарної енергії вихідних атомів.
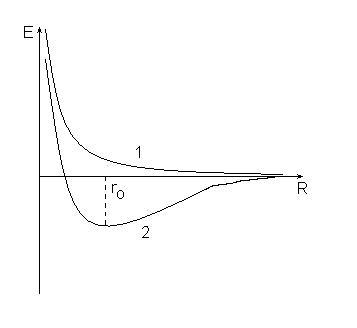
Така відмінність у поведінці атомів викликано різними значеннями спинового квантового числа для електронів у вихідних атомах. Якщо спини електронів були однаковими, то це крива 1, якщо різними - то 2:
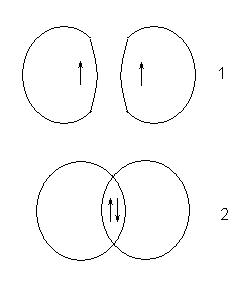
Стан, яке при цьому виникає, відповідає стійкій системі, в якій між ядрами атомів існує область з підвищеною електронною щільністю. Ця область компенсує взаємне відштовхування ядер і називається областю перекривання орбіталей або загальної електронної парою.
Так утворюється молекула водню. Так як орієнтація спина електрона в атомі водню равновероятности (половина атомів має електрон зі спіном +1/2, половина -1/2), при утворенні молекулярного водню з атомарного все атоми утворюють молекули.
Часто цей процес зображують у вигляді схеми, позначаючи електрони точками:
а загальну електронну пару - рисою:
Ковалентний зв'язок утворюється за двома механізмам - обмінним. коли кожен з беруть участь в утворенні зв'язку атомів надає для загальної електронної пари по одному електрону (А) і донорно-акцепторні. коли донор дає електронну пару, а акцептор - вільну орбіталь (В). На малюнку наведені схеми цих механізмів і відповідні їм реально протікають реакції:
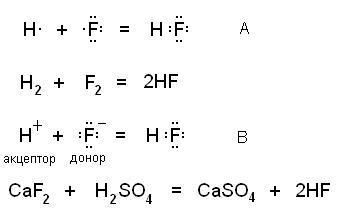
Утворені в результаті молекули нічим один від одного не відрізняються.
Полярний і неполярний ковалентний зв'язок
За симетрії розподілу заряду ковалентні зв'язку діляться на полярні та неполярні.
Якщо загальна електронна пара (область перекривання орбіталей) розташована симетрично щодо пов'язаних ядер, зв'язок називається ковалентним неполярной, якщо зміщена в бік одного з ядер - ковалентного полярної.
Ковалентний неполярний зв'язок виникає між атомами одного і того ж елемента, при цьому через симетрії розподілу зарядів зв'язок не володіє дипольним моментом. Приклади молекул з неполярной ковалентним зв'язком: H2. O2. F2, Cl2. N2. Ag2.
Якщо беруть участь в утворенні зв'язку атоми відрізняються по електронегативності, то виникає ковалентний полярна зв'язок. Загальна електронна пара зміщена в бік атома з більшою електронегативність, що виникає в результаті асиметрія в розподілі зарядів призводить до появи у зв'язку дипольного момента.Часто зміщення електронної пари показують стрілкою, наприклад:
Символом позначені дипольні заряди, які можуть бути менше заряду електрона, але існують тільки спільно.
Електронегативність атома вуглецю залежить від його гібридизації, в таблиці для порівняння наведені відносні електронегативності деяких атомів і гібридних станів вуглецю:
- і-зв'язку
- і-зв'язку розрізняють по симетрії перекривання орбіталей.
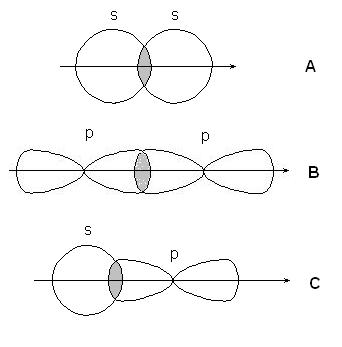
Якщо лінія, що з'єднує ядра пов'язаних атомів проходить через область перекривання орбіталей, зв'язок називається -зв'язком, якщо область перекривання лежить в стороні від цієї лінії - -зв'язком.
-зв'язку утворюються при перекривання s-s орбіталей атомів (А), р-p орбіталей (В), s-p орбіталей (С) і гібридних орбіталей:
-зв'язку - при перекривання р-р орбіталей:
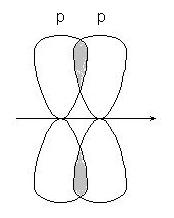
або р-d орбіталей:
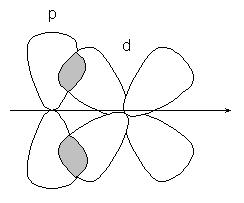
-зв'язок менш міцна, ніж -Зв'язок, її електрони легше піддаються зовнішньому впливу. У з'єднаннях з кратними зв'язками тільки одна з зв'язків є -cвязью, утворена перекриванням s, р або гібридних орбіталей, а решта - -зв'язків, освіченими перекриванням негібрідізованних р - орбіталей атомів, наприклад, подвійний зв'язок, утворена гібридними орбиталями (-зв'язок) і не які беруть участь в гібридизації р -орбіталямі (-зв'язок):
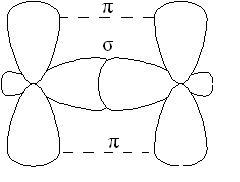
У молекулах алкенів, зокрема етилену, атоми вуглецю при двойнойсвязі знаходяться в стані sp 2-гібридизації, все З-Н ІС-З-зв'язку лежать в одній площині, перекривання негібридних р-орбіталей атомів углеродапроісходіт в площині, перпендикулярній площині -зв'язків. Іноді цю плоскостьназивают площиною-зв'язку:
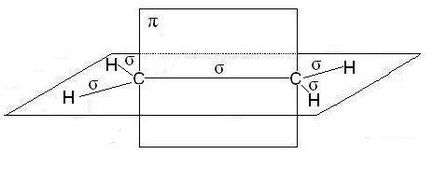
У разі потрійний зв'язку, наприклад в молекулах алкинов, наприклад, ацетилену, атоми вуглецю при зв'язку мають sp-гібридизацію, Дві-зв'язку, утворені перекриванням негібридних р-орбіталей атомів вуглецю (по дві від кожного) лежать в двох взаємно перпендикулярних площинах:
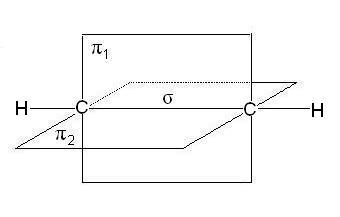
У таблиці наведені основні характеристики зв'язків між атомами вуглецю:
воднева зв'язок
Воднева зв'язок утворюється за донорно-акцепторного механізму між атомом водню, сполученим з електронегативним атомом і атомом, що має неподеленную пару електронів, наприклад:
Водень, пов'язаний з атомом вуглецю, нездатний до утворення водневого зв'язку.
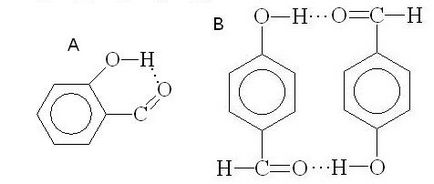
Енергія водневого зв'язку невелика (10 - 40 кДж / моль), проте вона в значній мірі впливає на фізичні і хімічні властивості сполук. З'єднання з міжмолекулярними водневими зв'язками мають значно більш високі температури кипіння, ніж з'єднання з тією ж молекулярної масою, але не асоційовані за рахунок водневих зв'язків. Наприклад, температура кипіння етанолу (78,3 o C) значно вище, ніж температура кипіння диметилового ефіру (24 o С). Навпаки, внутрішньо-молекулярні водневі зв'язки можуть призводити до зниження температури кипіння. Наприклад о-саліциловий альдегід (А, внутримолекулярная воднева зв'язок) має більшу летючість в порівнянні з п - гідроксибензальдегід (В, межмолекулярная воднева зв'язок):
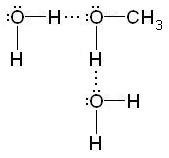
Освітою водневих зв'язків пояснюється розчинність багатьох органічних сполук в полярних розчинниках. Наприклад, у водному розчині відбувається гідратація нижчих спиртів:
Водневі зв'язки відіграють величезну роль у формуванні просторової структрури білків, вуглеводів, нуклеїнових кислот.