20. Консервативні токсиканти в водних екосистемах
20.1. Забруднення вод металами
Метали належать до числа головних неорганічних забруднювачів прісних і морських вод. Це, в основному, сполуки миш'яку, свинцю, кадмію, ртуті.
Гострота проблеми забруднення водного середовища токсичними металами визначається:
- високою концентрацією сполук важких металів в прибережних районах океану і внутрішніх морях;
- освітою високотоксичних металоорганічних комплексів, які як включаються в абиотический компонент екосистеми, так і поглинаються гідробіонтами;
- накопиченням металів гідробіонтами в дозах, небезпечних для людини.
Серед забруднюючих речовин за токсикологічними оцінками «стрес-індексів» важкі метали посідають друге місце, поступаючись тільки пестицидів.
Основні джерела надходження токсичних металів у водне середовище - пряме забруднення і стік з суші. Тільки води річок щороку привносять в океан понад 320 Мт заліза. Крім того, важлива роль в забрудненні гідросфери металами належить атмосферного переносу. Головні шляхи надходження металів в Світовий океан наведені в таблиці 29.
Природне і антропогенне забруднення Світового океану, т рік -1
На поверхню Світового океану щорічно випадає за іншими оцінками 200 кт свинцю і 5 кт ртуті. Внесок атмосферних випадінь свинцю в його загальний потік в Світовий океан в даний час вже перевищує геохімічний внесок цього елемента з річковими стоками. Для кадмію надходження в океан за рахунок атмосферних опадів і прямого стоку з суші близькі, а для ртуті атмосферне потік становить близько 25% загального надходження в океанську середу. Зараз вже визнано, що головним джерелом надходження важких металів у навколишнє середовище є не металургійне виробництво, а спалювання вугілля. Щорічне спалювання 2,4 млрд. Т кам'яного і 0,9 млрд. Т бурого вугілля розсіює в навколишнє середовище 200 кт миш'яку і 224 кт урану, а світове виробництво цих металів становить тільки 40 і 30 кт відповідно.
На шляху від місць попадання в воду до океану значна частина металів осідає на дні річок. Приклад наведено в таблиці 31.
(Мг кг -1 сухого ваги)
Крім того, значна частина металів на шляху до океану затримується в водоймах - як в їх донних опадах (таблиця 32), так і в біоті (таблиця 33).
Донні опади (мг кг -1 сухого ваги)
(Мг кг -1 сухого ваги)
Зябра (мг кг -1 сухого ваги)
М'язи (мг кг -1 сухого ваги)
Печінка (мг кг -1 сухого ваги)
Природно, що найбільше забруднення металами доводиться на моря і ті частини океану, де антропогенне активність висока. Більше за інших забруднені води Перської і Аденської заток Індійського океану, екваторіальна частина Тихого океану, води течії Гольфстрім в Атлантиці, Північне і Середземне моря.
Токсичність важких металів
Токсичність важких металів для планктону визначається тим, що планктонні організми (особливо фильтратори) концентрують метали, які через свою неразложимости зберігаються в живих тканинах необмежений час, сприяють загибелі планктонтов, а з відумерлою планктоном осідають в донних відкладеннях. Крім того, що вони акумулюються організмами, вони концентруються в харчових ланцюгах, що багато в чому, але не в усьому визначає різну токсичність металів для різних груп гідробіонтів (таблиця 34).
Ступінь токсичності ряду солей важких металів для деяких водних тварин
Миш'як широко розповсюджений в містять фосфати породах і відповідно зустрічається у вигляді домішок в фосфатних добривах або детергентах, вироблених їх цієї сировини. Звичайні форми миш'яку в природі: H3 AsO3. As (OH) 3. H3 AsO4.
Щорічно добувається приблизно 3,5 Мт свинцю, а з урахуванням повторного вилучення з відходів виробництво свинцю становить 4,1 Мт рік-1.
Забруднення природних вод і повітря свинцем відбувається в результаті процесу випалу і плавки свинцевих руд з метою отримання металевого свинцю, за рахунок викидів відходів з виробництв, що використовують свинець, а також при спалюванні вугілля, деревини та інших органічних матеріалів, включаючи міські відходи. Крім того, значні кількості свинцю потрапляють в навколишнє середовище завдяки використанню свинцевих труб для водопроводів і свинцево-кислотних акумуляторів.
До сих пір серйозними джерелами забруднення навколишнього середовища залишаються алкільні сполуки свинцю. Тільки за останні 40 років приблизно 10 Мт свинцю перероблено в тетраетилсвинець, який використовується в якості антидетонаторной присадки в автомобільному бензині. З антропогенних джерел свинцю цей вважається найважливішим. Кількість свинцю, щорічно потрапляє в океан в результаті застосування алкілсвінца як антидетонатора дизельного палива, оцінюється в 25 кт.
Pb (CH2 CH3) 4 додається в бензин, що дозволяє двигунам працювати при високому тиску. В бензин додають також CH2 Cl-CH2 Cl і CH2 Br-CH2 Br. В результаті згорання палива свинець потрапляє в атмосферу у вигляді аерозольних часток PbBrCl розміром менше 2 мкм, що потрапляють в легені і осідають там.
У навколишнє середовище ртуть надходить як з природних джерел, так і з джерел техногенного походження. Природна ртуть потрапляє в біосферу з відносно глибоких шарів земної кори завдяки вулканічної, гео- і гідротермальної активності.
Головні антропогенні джерела ртуті:
§ спалювання викопного палива;
§ викиди промислових підприємств, у тому числі найважливіші скиди стічних вод з електролізних фабрик по виробництву хлорощелочей і їдкого натру і підприємств, де сульфат ртуті використовується в якості каталізатора;
§ використання в сільському господарстві різних біоцидів, що містять сполуки ртуті.
Було підраховано, що в результаті діяльності людини в навколишнє середовище щорічно надходить до 10 кт ртуті, з яких 3 кт - за рахунок спалювання викопного палива. У морське середовище потрапляє близько 5 кт ртуті, загальна її кількість в водах Світового океану дорівнює 10 Мт при середній концентрації 0,01-0,03 мкг л -1.
Існують бактерії, які переводять мінеральну ртуть в монометил (або метил) ртуті (CH3Hg +) (див. Малюнок 42).
Ртуть токсична для фітопланктону, тому забруднення ртуттю істотно знижує первинну продукцію морських екосистем. Фіто-і зоопланктон акумулює ртуть в широкому діапазоні концентрацій 30-3 800 мкг кг-1 сухої маси, показник акумуляції ртуті може перевищувати 40 000.
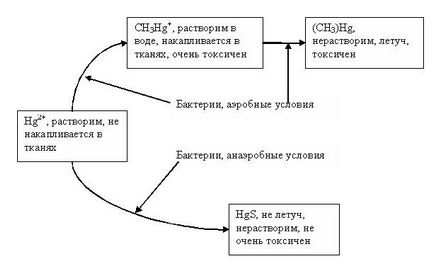
Рис 41. Поведінка ртуті у водному середовищі (до акумуляції організмами).
Відходи, що містять ртуть, зазвичай нагромаджуються в донних відкладеннях заток або естуаріях рік. Подальша її міграція супроводжується накопиченням метилової ртуті і її включенням у трофічні ланцюги водних організмів (особливо крабів і риб). Наприклад, в канадських озерах Сент-Клер концентрація ртуті в рибах становила 2-4 мг кг -1. в м'язах великий блакитний чаплі 23 мг кг -1. в печінці - 175 мг кг -1 (Рамаді, 1981).
У природі кадмій, як правило, асоційований з цинком і їх поділ економічно нерентабельно.
Щорічно у всьому світі видобувається до 18 кт кадмію (Ізраель, 1989). Кадмій широко використовується в електронній промисловості, виробництві пластмас, барвників, розчинників. Найбільш відоме його використання в нікелі-кадмієвих акумуляторах.
В навколишньому середовищу кадмій присутній у вигляді двовалентного іона, що осідає у вигляді карбонату:
У кислому середовищі іони кадмію звільняються:
До основних антропогенних джерел надходження кадмію в навколишнє середовище відносяться гірничорудні і металургійні підприємства, а також стічні води. Куріння поставляє в навколишнє середовище 6-11 т кадмію щорічно (Гадаскіна, 1988).
Всього води Світового океану містять приблизно 140 Мт кадмію при середній концентрації 0,1 мкг л -1. Кадмій накопичується водними тваринами, але не концентрується в харчових ланцюгах (Ізраель, 1989). Концентрація кадмію в різних гідробіонтах змінюється від 50 до 550000 мкг кг -1 сухої маси. У деяких видів устриць, наприклад, коефіцієнт накопичення кадмію дорівнює 318 000 (Ерхард, 1984).
Кадмій - один з найнебезпечніших токсикантів. Токсичність кадмію пов'язана зі схожістю його хімічних властивостей з цинком. При цьому він зв'язується з сірої міцніше, ніж цинк і, отже, витісняє цинк з багатьох ферментів, в яких той використовується як ко-фактор. Природно, ці ферменти припиняють функціонувати.