Створення досить зручних і по можливості універсальних векторів для цільової доставки генів в клітини тканини і організму
Генна інженерія як метод біотехнології
Генна інженерія - це метод біотехнології, який займається
дослідженнями з перебудови генотипів. Генотип є не просто механічна сума генів, а складна, що склалася в процесі еволюції
організмів система. Генна інженерія дозволяє шляхом операцій в пробірці переносити генетичну інформацію з одного організму в інший. Перенесення генів дає можливість долати міжвидові бар'єри і передавати окремі спадкові ознаки одних організмів іншим.
Носіями матеріальних основ генів служать хромосоми, до складу яких входять ДНК і білки. Але гени освіти не хімічні, а функціональні. З функціональної точки зору ДНК складається з безлічі блоків, що зберігають певний обсяг інформації - генів. В основі дії гена лежать його здатність за посередництвом РНК визначати синтез білків. У молекулі ДНК як би записана інформація, яка визначає хімічну структуру білкових молекул. Ген - ділянка молекули ДНК, в якому знаходиться інформація про первинну структуру якого-небудь одного білка (один ген - один білок). Оскільки в організмах присутні десятки тисяч білків, існують і десятки тисяч генів. Сукупність усіх генів клітини становить її геном. Всі клітини організму містять однаковий набір генів, але в кожній з них реалізується різна частина інформації, що зберігається. Тому, наприклад, нервові клітини і по структурно-функціональним, і за біологічними особливостями відрізняються від клітин печінки.
Перебудова генотипів, при виконанні завдань генної інженерії,
являє собою якісні зміни генів пов'язані з видимими в мікроскопі змінами будови хромосом. Зміни генів перш за все пов'язано з перетворенням хімічної структури ДНК. Інформація про структуру білка, записана у вигляді послідовності нуклеотидів, реалізується у вигляді послідовності амінокислот в синтезується молекулі білка. Зміна послідовності нуклеотидів в хромосомної ДНК, випадання одних і включення інших нуклеотидів змінюють склад утворюються на ДНК молекули РНК, а це, в свою чергу, обумовлює нову послідовність амінокислот при синтезі. В результаті в клітині починає синтезуватися новий білок, що приводить до появи у організму нових властивостей. Сутність методів генної інженерії полягає в тому, що в генотип організму вбудовуються або вилучаються з нього окремі гени або групи генів. В результаті вбудовування в генотип раніше відсутнього гена можна змусити клітину синтезувати білки, які раніше вона не синтезувала. [1]
Найбільш поширеним методом генної інженерії є метод
отримання рекомбінантних, тобто містять чужорідний ген, плазмід. Плазміди є кільцеві двухцепочние молекули ДНК, що складаються з декількох тисяч пар нуклеотидів. Цей процес складається з декількох етапів.
1. Рестрикція - розрізання ДНК, наприклад, людини на фрагменти.
2. Лігування - фрагмент з потрібним геном включають в плазміди і зшивають їх.
3. Трансформація-введення рекомбінантних плазмід в бактеріальні клітини.
Трансформовані бактерії при цьому набувають певні властивості. Кожна з трансформованих бактерій розмножується і утворює колонію з багатьох тисяч нащадків - клон.
4. Скринінг - відбір серед клонів трансформованих бактерій тих, які плазміди, що несуть потрібний ген людини.
Весь цей процес називається клонуванням. За допомогою клонування
можна отримати більше мільйона копій будь-якого фрагмента ДНК людини або
іншого організму. Якщо клонований фрагмент кодує білок, то
експериментально можна вивчити механізм, який регулює транскрипцію цього гена, а також напрацювати цей білок в потрібній кількості. Крім того,
клонований фрагмент ДНК одного організму можна ввести в клітини іншого організму. Цим можна домогтися, наприклад, високі і стійкі врожаї завдяки введеному гену, що забезпечує стійкість до ряду хвороб. Якщо ввести в генотип грунтових бактерій гени інших бактерій, що володіють здатністю зв'язувати атмосферний азот, то грунтові бактерії зможуть переводити цей азот в зв'язаний азот грунту. Ввівши в генотип бактерії кишкової палички ген з генотипу людини, що контролює синтез інсуліну, вчені домоглися отримання інсуліну за допомогою такої кишкової палички. При подальшому розвитку науки стане можливим введення в зародок людини відсутніх генів, і тим самим дозволить уникнути генетичних хвороб. [2]
Експерименти з клонування тварин ведуться давно. Досить прибрати з яйцеклітини ядро, імплантувати в неї ядро іншої клітини, взятої з ембріональної тканини, і виростити її - або в пробірці, або в утробі
названої матері. Клонована овечка Долі була створена нетрадиційним шляхом. Ядро з клітини вимені 6-річної дорослої вівці однієї породи пересадили в без'ядерний яйце вівці іншої породи. Розвивається зародок помістили в вівцю третин породи. Так як народилася овечка отримала всі гени від першої вівці - донора, то є її точною генетичною копією. Цей експеримент відкриває масу нових можливостей для клонування елітних порід, замість багаторічної селекції.
Вчені Техаського університету змогли продовжити життя декількох типів людських клітин. Зазвичай клітина вмирає, переживши близько 7-10 процесів розподілу, а вони домоглися сто поділів клітини. Старіння, на думку вчених, відбувається через те, що клітини при кожному діленні втрачають теломери, молекулярні структури, які розташовуються на кінцях всіх хромосом. Вчені імплантували в клітини відкритий ними ген, відповідальний за вироблення теломерази і тим самим зробили їх безсмертними. Можливо це майбутній шлях до безсмертя.
Ще з 80-х років з'явилися програми з вивчення геному людини. В
2. Методи, які використовують в генній інженерії
Методи генної інженерії використовують в певній послідовності, причому розрізняють кілька стадій у виконанні типового генно-інженерного експерименту, спрямованого на клонування будь-якого гена, а саме:
1. Виділення ДНК з клітин цікавить організму (вихідного) і виділення ДНК-вектора.
2. Розрізання (рестрикция) ДНК вихідного організму на фрагменти, що містять питання, що цікавлять гени, за допомогою одного з ферментів-рестриктаз і виділення цих генів з утвореної рестрикційних суміші. Одночасно розрізають (рестрікцііруют) векторну ДНК, перетворюючи її з кільцевої структури в лінійну.
3. змикання цікавить сегмента ДНК (гена) з ДНК вектора з метою отримання гібридних молекул ДНК.
4. Введення гібридних молекул ДНК шляхом трансформації в будь-якій іншій організм, наприклад, в Е. coli або в соматичні клітини.
5. Висів бактерій, в які вводили гібридні молекули ДНК, на поживні середовища, що дозволяють зростання тільки клітин, що містять гібридні молекули ДНК.
6. Ідентифікація колоній, що складаються з бактерій, що містять гібридні молекули ДНК.
7. Виділення клонованої ДНК (клонованих генів) і її характеристика, включаючи секвенування азотистих основ в клонованому фрагменті ДНК.
ДНК (вихідна і векторна), ферменти, клітини, в яких клонують ДНК - все це називають «інструментами» генної інженерії.
3. Генетичні вектори
Під поняттям "вектор" розуміється молекула нуклеїнової кислоти, здатна після введення в клітку до автономного існування за рахунок наявності в ній сигналів реплікації і транскрипції.
Векторні молекули повинні мати наступні властивості:
1) здатністю автономно реплицироваться в клстке-реципієнта, тобто бути самостійним репліконом;
2) містити один або кілька маркерних генів, завдяки експресії яких у клітини-реципієнта з'являються нові ознаки, що дозволяють відрізнити трансформовані клітини від вихідних;
3) містити по одному або, найбільше, по дві ділянки (сайту) для різних рестриктаз в різних районах (в тому числі в складі маркерних генів), але не в області, відповідальної за їх реплікацію.
Залежно від цілей експерименту вектори можна умовно розділити на дві групи: 1) що використовуються для клонування і ампліфікації потрібного гена; 2) спеціалізовані, що застосовуються для експресії вбудованих чужорідних генів. Друга група векторів об'єднує вектори, покликані забезпечити синтез білкових продуктів клонованих генів. Вектори для експресії містять послідовності ДНК, які необхідні для транскрипції клонованих копій генів і трансляції їх мРНК в штамах клітин. [4]
Як прокариотических векторів використовуються плазміди, бактеріофаги; як еукаріотичних векторів застосовують віруси тварин і рослин, вектори на основі 2 мкм дріжджів і мітохондрій і ряд штучно сконструйованих векторів, здатних реплицироваться як в бактеріальних, так і в клітині (човникові вектори).
Плазміди - це позахромосомних генетичні елементи про- і еукаріот, які автономно реплікуються в клітинах. Більшість плазмідних векторів отримано на основі природних плазмід ColE1, pMB1 і p15A.
Бактеріальні плазміди поділяють на два класи. Одні плазміди (наприклад, добре вивчений фактор F, що визначає стать у E.coli) самі здатні переходити з клітини в клітину, інші такою здатністю не володіють. По ряду причин, і перш за все для запобігання неконтрольованого розповсюдження потенційно небезпечного генетичного матеріалу, переважна більшість бактеріальних плазмідних векторів створено на базі плазмід другого класу. Багато природних плазміди вже містять гени, що визначають стійкість клітин до антибіотиків (продукти цих генів - ферменти, модифікують або розщеплюють антибіотичні речовини). Крім того, в ці плазміди при конструюванні векторів вводяться додаткові гени, що визначають стійкість до інших антибіотиків. [5]
На рис. 1 показаний один з найпоширеніших плазмідних векторів E.coli - pBR322. Він сконструйований на базі детально вивченої плазміди E.coli - коліціногенного фактора ColE1 - і містить оріджін реплікації цієї плазміди. Особливість плазміди ColE1 (і pBR322 відповідно) полягає в тому, що в присутності інгібітора синтезу білка антибіотика хлорамфеніколу (опосередковано інгібуючої реплікацію хазяйської хромосоми) її число в E.coli зростає від 20-50 до 1000 молекул на клітину, що дозволяє отримувати великі кількості клонируемого гена. При конструюванні вектора pBR322 з вихідних плазмід був делегований цілий ряд "зайвих" сайтів для рестриктаз.
Малюнок 1. Детальна рестрикционная карта плазміди pBR322.
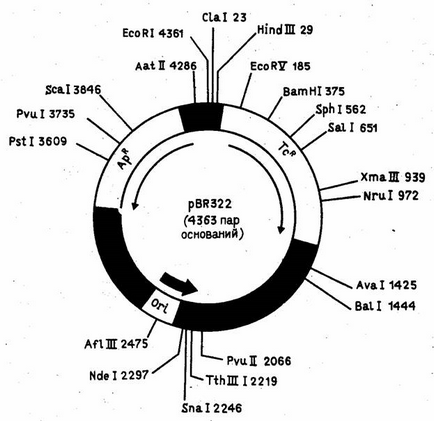
В даний час поряд з безліччю зручних векторних систем для E.coli сконструйовані плазмідні вектори для ряду інших грамнегативних бактерій (в тому числі таких промислово важливих, як Pseudomonas, Rhizobium і Azotobacter), грампозитивних бактерій (Bacillus), нижчих грибів (дріжджі) і рослин .
Плазмідні вектори зручні для клонування відносно невеликих фрагментів (до 10 тис. Пар основ) геномів невеликих розмірів. Якщо ж потрібно отримати клонотекі (або бібліотеку) генів вищих рослин і тварин, загальна довжина геному яких досягає величезних розмірів, то звичайні плазмідні вектори для цих цілей непридатні. Проблему створення бібліотек генів для вищих еукаріот вдалося вирішити з використанням в якості клонують векторів похідних бактеріофага l.
Серед фагів векторів найбільш зручні системи були створені на базі геномів бактеріофагів l і М13 E.coli. ДНК цих фагів містить протяжні області, які можна делегувати або замінити на чужорідну ДНК, не зачіпаючи їх здатності реплицироваться в клітинах E.coli. При конструюванні сімейства векторів на базі ДНК l фага з неї спочатку (шляхом поділів коротких ділянок ДНК) були видалені багато сайтів рестрикції з області, не суттєвою для реплікації ДНК, і залишені такі сайти в області, призначеної для вбудовування чужорідної ДНК. У цю ж область часто вбудовують маркерні гени, що дозволяють відрізнити рекомбінантний ДНК від вихідного вектора. Такі вектори широко використовуються для отримання "бібліотек генів". Розміри заміщає фрагмента фагової ДНК і відповідно вбудованого ділянки чужорідної ДНК обмежені 15-17 тис. Нуклеотидних залишків, так як рекомбінантний Фаго геном, який на 10% більше або на 75% менше геному дикого l фага, вже не може бути упакований в фагів частинки. [6]
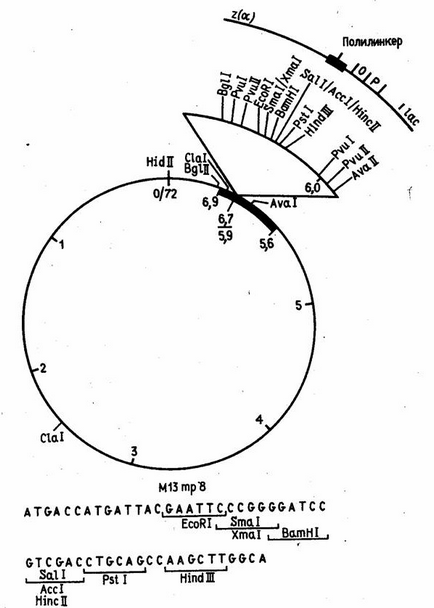
Таких обмежень теоретично не існує для векторів, сконструйованих на базі нитчастих бактеріофага М13. Описані випадки, коли в геном цього фага була вбудована чужорідна ДНК довжиною близько 40 тис. Нуклеотидних залишків. Відомо, однак, що фаг М13 стає нестабільним, коли довжина чужорідної ДНК перевищує 5 тис. Нуклеотидних залишків. Фактично ж вектори, отримані з ДНК фага М13, використовуються головним чином для секвенування і мутагенезу генів, і розміри вбудованих в них фрагментів набагато менше.
Ці вектори конструюються з реплекатівной (двутяжевой) форми ДНК фага М13, в яку вбудовані "полілінкерние" ділянки (приклад такої конструкції показаний на рис. 2). У фагів частку ДНК включається у вигляді однотяжевой молекули. Таким чином, цей вектор дозволяє отримувати клонований ген або його фрагмент як в двутяжевой, так і в однотяжевой формі. Однотяжевие форми рекомбінантних ДНК широко використовуються в даний час при визначенні нуклеотидної послідовності ДНК методом Сенгера і для олігодезоксінуклеотід-спрямованого мутагенезу генів.
Перенесення чужорідних генів в клітини тварин здійснюється за допомогою векторів, отриманих з ДНК ряду добре вивчених вірусів тварин - SV40, деяких аденовірусів, вірусу папіломи бика, вірусу віспи і так далі. Конструювання цих векторів проводиться за стандартною схемою: видалення "зайвих" сайтів для рестриктаз, введення маркерних генів в області ДНК, неістотні для її реплікації (наприклад, гена тимидин-кінази (tk) з HSV (вірусу герпесу)), введення регуляторних районів, підвищують рівень експресії генів.
Зручними виявилися так звані "човникові вектори", здатні реплицироваться як в клітинах тварин, так і в клітинах бактерій. Їх отримують, зшиваючи один з одним великі сегменти векторів тварин і бактерій (наприклад, SV40 і pBR322) так, щоб райони, відповідальні за реплікацію ДНК, залишилися непорушними. Це дозволяє проводити основні операції з конструювання вектора в бактеріальної клітці (що технічно набагато простіше), а потім отриману рекомбінантний ДНК використовувати для клонування генів в тваринній клітині. [7]
Малюнок 2. рестрикційний карта вектора М13 mp8.
4. Створення досить зручних і по можливості універсальних векторів для цільової доставки генів в клітини тканини і організму
Важливим моментом при конструюванні ДНК-вакцин є проблема цілеспрямованої доставки генів в необхідні клітки і захисту вводяться ДНК від дії нуклеаз крові. В результаті експериментальної роботи були створені різноманітні конструкції, що дозволяють доставляти цільові гени в клітини-мішені.
Однією з подібних конструкцій є модель молекулярного вектора для доставки генів в такі клітини, як лімфоцити і кераноціти. Як модельний був використаний ген, що кодує гібридний білок: фактор некрозу пухлин-альфа - інтерферон-гамма. У центрі вектора знаходиться интактная плазмідна ДНК, що містить доставляється ген, а на поверхні розташовуються антитіла до клітин-мішеней. Кон'югат поліглюкіну зі спермідін і антитілами застосовується для зв'язку компонентів (позитивно заряджений спермидин забезпечує зв'язування кон'югату з плазмідної ДНК). Описаний молекулярний вектор дозволяє цілеспрямовано доставляти гени в клітини-мішені, зводячи до мінімуму їх потрапляння в інші види клітин, захищати доставляються гени від нуклеаз крові і використовувати позитивно заряджений комплекс спермидин-поліглюкін в якості стимулятора проникнення ДНК в клітини.
В даний час також створена векторна модель для доставки в клітини кісткового мозку гена, що кодує гранулоцитарнийколонієстимулюючий фактор людини (Чг-КСФ). Даний білок відноситься до сімейства гемопоетичних факторів росту і є одним з фізіологічних регуляторів, специфічно і високоефективно стимулюючих проліферацію і диференціювання гемопоетичних попередників нейтрофілів. Чг-КСФ збільшує тривалість життя клітин кісткового мозку, посилює функціональну активність зрілих нейтрофілів. Створений вектор являє собою багатошарову конструкцію. "Центральним ядром" конструкції є плазміда pGGF8, що містить ген Чг-КСФ. Її оточує полисахаридная оболонка, яка складається з поліглюкіну і спермидина. Зовнішній білковий шар містить суміш сироватковогоальбуміну і білка доставки - трансферина. Ефективність описаної векторної моделі була доведена досвідченим шляхом.
1. Грен Е. Я. Пумп П. П. Рекомбінантні вірусні капсиди - нове покоління імуногенних білків і вакцин // Журнал ВХО. - 1988. - т. II, №5. - с. 531-536.
2. Дмитрієв Б. А. Проблеми і перспективи створення синтетичних вакцин // Імунологія. - 1986. - №1. - с. 24-29.
4. Мерців Н. П. Беклемишев А. Б. Савич І. М. Сучасні підходи до конструювання молекулярних вакцин. - Новосибірськ: Наука, 1987, 210 с.
7. Щелкунов С. Н. Клонування генів. - Новосибірськ: Наука, 1986, 232 с.