Cтроеніе атома і електронні оболонки
Перше завдання в ОГЕ з хімії перевіряє знання в області будови атома і будови електронних оболонок атомів перших 20 елементів періодичної системи Менделєєва. Тому для успішного вирішення першого завдання нам будуть потрібні знання в цій галузі. Що ж нам необхідно знати?
Теорія до завдання №1 ОГЕ з хімії
Всі атоми складаються з ядра та електронної оболонки. Ядро тому так і називається, так як воно розташоване в самому центрі і дуже-дуже маленьке. Ядро заряджена позитивно. Позитивний заряд ядра прідаютпротони - позитивно заряджені елементарні частинки. Один протон несе в собі заряд +1. Таким чином, скільки в ядрі протонів, такий і заряд ядра. Заряд ядра, а отже і кількість протонів показує нам порядковий номер елемента в таблиці Менделєєва. Якщо порядковий номер 2, то заряд ядра дорівнює двом - це ядро гелію - другого елемента в періодичній таблиці.
Порядковий номер елемента показує також і кількість електронів в електронній оболонці. Електронна оболонка оточує ядро і компенсує позитивний заряд ядра негативними зарядами електронів. Більш того, електронна оболонка обумовлює протікання всіх хімічних реакцій - саме зміна складу електронної оболонки і її змін пояснює природу хімічних реакцій. Як і ядро, оболонка складається з елементарних частинок - електронів. Електрони, на відміну від протонів, несуть заряд -1 - електронна оболонка заряджена негативно. Але крім цього, є ще одна важлива відмінність електрона від протона - протон має вагу 1, а електрон не має ваги (насправді це не так, але для вирішення завдань нам не знадобляться знання про маси елементарних частинок).
Крім протонів, в ядрі містяться нейтрони - незаряджені елементарні частинки з масою 1. Вони надають тільки вага атома і ядра, але не заряд. Кількість нейтронів можна знайти, знаючи масу елемента і його порядковий номер, так як порядковий номер показує кількість протонів і їх сумарну масу, а молекулярна маса - загальну масу. Таким чином, віднімаючи із загальної маси масу протонів, ми отримуємо кількість нейтронів.
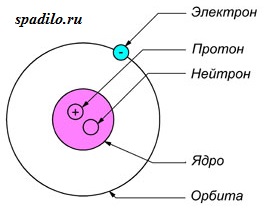
Сумарний заряд атома нейтральний, це означає, що кількість протонів дорівнює кількості електронів.
Електрони в оболонці розташовані упорядковано - шарами. Кількість шарі визначає номер періоду в періодичній таблиці.
Число шарів визначається номер періоду. в якому стоїть елемент.
У першому періоді може бути максимально два електрони, в другому - вісім, в третьому - вісім. Заповнення електронних оболонок перших трьох періодів йде поступово - спочатку повністю заповнюється перший, потім повністю другий і третій.
Число вільних неспарених електронів визначається за формулою 8-n, де n - номер групи, в якій стоїть хімічний елемент.
На цьому теоретичний екскурс закінчено і ми можемо приступити до розбору типових завдань.
Розбір типових варіантів завдань №1 ОГЕ з хімії
Перший варіант завдання
В атомі калію розподіл електронів по електронним верствам відповідає ряду чисел:
Так як елемент калій варто в 4-му періоді, в головній підгрупі 1-ої групи, його порядковий номер 19. Отже, 19 електронів розподілені по 4-м верствам. На першому шарі 2 електрона, на другому 8, на третьому вісім, і на четвертий залишається один, значить схема будови:
Другий варіант завдання
Скільки електронів містить атом алюмінію?
У алюмінію порядковий номер 13, а значить і електронів у нього 13.
Третій варіант завдання
Число протонів в атомі одно
- числу електронів
- відносною атомною масою
- числу нейтронів
- заповнених електронних шарів
З вищевикладеного мною матеріалу кількість протонів дорівнює кількості електронів.
Четвертий варіант завдання
Число заповнюються електронних шарів в атомі одно
- порядковому номеру елемента
- номеру групи
- заряду ядра атома
- номеру періоду
Число заповнюються електронних шарів дорівнює номеру періоду.
П'ятий варіант завдання
Для елементів головних підгруп число електронів в зовнішньому електронному шарі атома одно
- числу нейтронів
- номеру періоду
- заряду ядра атома
- номеру групи
У головних підгрупах (знаки елементів стоять зліва в комірці таблиці) число електронів в зовнішньому шарі дорівнює номеру групи.
Шостий варіант завдання
Атоми азоту і фтору мають однакове
- значення радіусів атомів
- значення зарядів ядер атомів
- число електронів в зовнішньому електронному шарі
- число заповнених електронних шарів
Так як азот і фтор стоять в одному періоді, значить у них однакове число електронних шарів. До слова, не буває різних елементів з однаковими радіусами атомів, значеннями зарядів ядер.
Сьомий варіант завдання
Атоми вуглецю і кремнію мають однакове
- число нейтронів в ядрі атома
- значення відносної атомної маси
- число протонів в ядрі атома
- число валентних електронів
Так як вуглець і кремній знаходяться в одній групі (четвертої), то у них однакове число валентних електронів.
Восьмий варіант завдання
Схема розподілу електронів по електронним верствам 2, 8, 7 відповідає атому
Сумарне число електронів:
Знаходимо 17 елемент - це хлор.