Патологія білкового обміну
Білки - неразветвляющіеся полімери, мінімальна структурна одиниця яких - амінокислота (АК).
Амінокислоти з'єднані між собою пептидного зв'язком. До складу білків входить 20 АК в альфа-формі, розташованих в різній, але строго визначеної для кожного білка послідовності.
Білки організму включають близько 16% азоту, який в ряді методів є маркером речовини білкового походження.
Відомості про сумарну кількість білків плазми (загальний білок крові) отримують зазвичай рефрактометрическим і фотометричним біуретового методами.
Плазма крові людини в нормі містить понад 100 видів білків.
Близько 20% загального білка складають альбуміни, імуноглобуліни, ліпопротеїди, фібриноген, трансферин і ін.
Нормальні величини загального білка плазми: 65-85 г / л.
I. За хімічною будовою
§ Алифатические - гліцин (Гли), аланін (Ала), валін (Вал), лейцин (Лей), ізолейцин (Илей);
§ Оксикислоти - серин (Сер), треанін (Тре);
§ Дикарбонові - аспарагін (АСП), глутамін (Гли), аспарагінова кислота (Аск), глутамінова кислота (ГЛК);
§ двуосновних - лізин (Ліз), гістидин (Гіс), аргінін (Арг);
§ Ароматичні - феніналанін (Фен), тирозин (Тир), триптофан (Три);
§ Серосодержащіе - цистеїн (Цис), метіонін (Мет).
II. За біохімічної ролі:
§ глюкогенние - через ряд хімічних перетворень надходять на шлях гліколізу (окислення глюкози) - Гли, Ала, Тре, Вал, Аск, ГЛК, Арг, Гіс, Мет.
§ кетогенні - беруть участь в утворенні кетонових тіл - Лей, Илей, Тир, Фен.
§ Незамінні - не синтезуються в організмі - Гіс, Ілі, Лей, Ліз, Мет, Фен, Тре, Три, Вал.
За рахунок наявності в молекулі АК одночасно аминной і карбоксильної груп цих сполук притаманні кислотно-основні властивості. У нейтральному середовищі АК існують у вигляді біполярних іонів - цвіттер-іонів тобто НЕ NH2 - -COOH. а NH3 + -R-COO -.
Якщо карбоксильная група однієї АК ацилуючий аминогруппу інший АК, то утворюється ковалентний амидная зв'язок, яку називають пептидного. Т.ч. пептиди - це з'єднання, утворені із залишків альфа-АК, з'єднаних між собою пептидним зв'язком.
Даний зв'язок досить стабільна і розрив її відбувається лише за участю каталізаторів - специфічних ферментів. За допомогою такого зв'язку АК об'єднуються в досить довгі ланцюжки, які носять назву поліпептидних. Кожна така ланцюг містить на одному кінці АК з вільною аміногрупою - це N-кінцевий залишок, і на іншому з карбоксильною групою - С-кінцевий залишок.
Поліпептиди, здатні спонтанно формувати і утримувати певну просторову структуру, яка називається конформацией, відносять до білків.
Стабілізація такої структури можлива лише при досягненні полипептидами певної довжини, тому білками зазвичай вважають поліпептиди молекулярної масою більше 5 000 Да. (1 Так дорівнює 1/12 ізотопу вуглецю). Тільки маючи певний просторове будова, білок може функціонувати.
1. Структурна (пластична) - білками утворені багато клітинні компоненти, а в комплексі з ліпідами вони входять до складу клітинних мембран.
2. Каталітична - все біологічні каталізатори - ферменти за своєю хімічною природою є білками.
3. Транспортна - білок гемоглобін транспортує кисень, ряд інших білків утворюючи комплекс з ліпідами транспортують їх по крові і лімфі (наприклад, міоглобін, сироватковий альбумін).
4. МЕХАНОХІМІЧНО - м'язова робота і інші форми руху в організмі здійснюються за безпосередньої участі скорочувальних білків з використанням енергії макроергічних зв'язків (наприклад, актин, міозин).
5. Регуляторна - ряд гормонів та інших біологічно активних речовин мають білкову природу (наприклад, інсулін, АКТГ).
6. Захисна - антитіла (імуноглобуліни) є білками, крім того, основу шкіри становить білок колаген, а волосся - кератин. Шкіра і волосся захищають внутрішнє середовище організму від зовнішніх впливів. До складу слизу і синовіальної рідини входять мукопротєїди.
7. Опорна - сухожилля, поверхні суглобів з'єднання кісток утворені в значній мірі білковими речовинами (наприклад, колаген, еластин).
8. Енергетична - амінокислоти білків можуть надходити на шлях гліколізу, який забезпечує клітину енергією.
9. Рецепторная - багато білків беруть участь в процесах виборчого впізнавання (рецептори).
Рівні організації білкової молекули
У сучасній літературі прийнято розглядати 4 рівня організації структури молекули білка.
Послідовність амінокислотних залишків, з'єднаних між собою пептидного зв'язком називають первинним рівнем організації білкової молекули. Вона кодується структурним геном кожного білка. Зв'язки: пептидная і дисульфідні містки між відносно близько розташованими залишками цистеїну. Це ковалентні взаємодії, які руйнуються тільки під дією протеолітичних ферментів (пепсин, трипсин і т.д.).
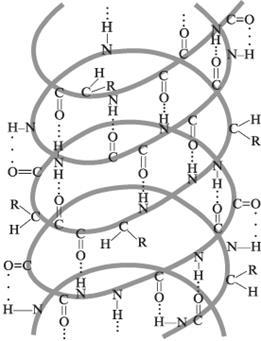
Вторинної структурою називають просторове розташування атомів головного ланцюга молекули білка. Існує три типи вторинної структури: альфа-спіраль, бета-складчастість і бета-вигин. Утворюється і утримується в просторі за рахунок утворення водневих зв'язків між бічними угрупованнями АК основному ланцюзі. Водневі зв'язки утворюються між електронегативними атомами кисню карбонільних груп і атомами водню двох амінокислот.
Альфа-спіраль - це пептидная ланцюг штопорообразно закручена навколо уявного циліндра. Діаметр такої спіралі 0,5 А. У природних білках виявлено тільки права спіраль. Деякі білки (інсулін) мають дві паралельні спіралі. Бета-складчастість - поліпептидний ланцюг зібрана в рівнозначні складки. Бета-вигин - утворюється між трьома амінокислотами за рахунок водневого зв'язку. Він необхідний для зміни просторового розташування поліпептидного ланцюга при утворенні третинної структури білка.
Третинна структура - це властивий даному білку спосіб укладання поліпептиди ланцюга в просторі. Це основа функціональності білка. Вона забезпечує стабільність великих ділянок білка, що складаються з безлічі амінокислотних залишків і бічних груп. Такі впорядковані в просторі ділянки білка формують активні центри ферментів або зони зв'язування. Пошкодження третинної структури призводить до втрати функціональної активності білка.
Стабільність третинної структури залежить в основному від нековалентних взаємодій всередині білкової глобули - переважно водневих зв'язків, ван дер Ваальсових сил (іонних або електростатичних) і гідрофобних взаємодій. Але деякі білки додатково стабілізуються за рахунок таких ковалентних взаємодій як дисульфідні містки межу залишками цистеїну.
Більшість білкових молекул мають ділянки як альфа-спіралі так і бета-складчастості. Але частіше за формою третинної структури поділяють глобулярні білки - побудовані переважно з альфа-спіралей і імеющеіе форму кулі або еліпса (більшість ферментів). І фібрілярние - складаються пеімущественно з бета-складчастості і мають сплюснуту або ниткоподібну форми (пепсин, білки сполучної такни і хряща).
Розміщення в просторі взаємодіючих між собою субодиниць, утворених окремими поліпептидними ланцюгами, називається четвертинної структурою. Тобто в формуванні четвертинної структури беруть участь не пептидні ланцюга самі по собі, а глобули, утворені кожною з цих ланцюгів окремо. Четвертичная структура - це вищий рівень організації білкової молекули і він притаманний далеко не всім білків. Зв'язки, що формують цю структуру Нековалентні: водневі, електростатичні.
Фундаментальний принцип молекулярної біології. послідовність амінокислотних залишків поліпептидного ланцюга білка несе в собі всю інформацію, яка необхідна для формування певної просторової структури. Тобто наявна в даному білку амінокислотна послідовність зумовлює утворення альфа- або бета-конформації вторинної структури за рахунок утворення між цими АК водневих або дисульфідних зв'язків і надалі формування глобулярної або фибрилярную структури також за рахунок нековалентних взаіомдействій між бічними учатке певних амінокислот.
II. За конформационной структурі:
§ фібрилярні (колаген, еластин, кератину),
§ глобулярні: альбуміни, глобуліни, гістони (всі ферменти і більшість БАВ).
III. За хімічною будовою:
1. Протеїни - складаються тільки з амінокислот.
a) Альбуміни - розчинні у воді, нерозчинні в концентрованих розчинах солей.
b) Глобуліни - не розчинні у воді, розчинні в сольових розчинах.
c) Гістони - розчинні у воді, в слабоконцентрірованних кислотах. Мають виражені основні властивості. Це ядерні білки, вони пов'язані з ДНК і РНК.
d) Склеропротеіни - білки опорних тканин (хрящів, кісток), вовни, волосся. Чи не розчиняються у воді, слабких кислотах і лугах.
§ колаген - фібрілярние білки сполучної тканини. При тривалому кип'ятінні вони розчиняються у воді і при застудненні утворюється желатин.
§ еластину - білки зв'язок і сухожиль. За властивостями схожі на колаген, але піддаються гідролізу під дією ферментів травного соку;
§ кератин - входить до складу волосся;
2. Протеїди - крім АК мають у складі небілкової частина (Глік, липо-, метало-, фосфо, нуклео-, хромопротеїди)
a) Нуклеопротеїди - простетическая група - нуклеїнові кислоти. Серед численних класів нуклеопротеидов найбільш вивченими є рибосоми, що складаються з декількох молекул РНК і рибосомних білків, і хроматин - основний нуклеопротеїд еукаріотів, що складається з ДНК і структуроутворюючих білків - гістонів (містяться в клітинному ядрі і мітохондріях).
b) гемопротеидов - небілковий компонент цих протеидов - гем, побудований з чотирьох піррольних кілець, з ними пов'язаний іон двовалентного заліза (через атоми азоту). До таких білка відносяться: гемоглобін, міоглобін, цитохроми. Цей клас білків ще називають хромопротеїди, оскільки гем є забарвленим з'єднанням. Гемоглобін - транспорт кисню. Міоглобін - запасання кисню в м'язах. Цитохроми (ферменти) - каталіз окислювально-восстановаітельних реакцій і електронний транспорт в дихальної ланцюга.
c) Металлопротєїди - до складу простетичної групи входять метали. Цитохром а - містить мідь, сукцинатдегідрогеназа і ін. Ферменти містять негеміновое залізо (ферродоксін).
d) Ліпопротєїди - містять ліпіди, входять до складу клітинних мембран
e) Фосфопротеіди - містять залишок фосфорної кислоти
f) глюкопротеідамі - містять цукру