Фізіологія людини. Оригінальна класифікація гістологічних варіантів рабдоміосарком у дітей, описана в 1958 році, об'єднує пухлини з певних типів клітин, такі як ембріональні, альвеолярні, ботріоідние і поліморфно-клітинні. Дослідження гістології пухлин в IRS додало в цю класифікацію примітивні дрібноклітинні саркоми I і II і невизначені недиференційовані форми.
До сприятливих типів відносяться ембріональні, включаючи ботріоідние варіант, внекостного саркома Юінга і недиференційовані або змішані типи пухлин. Гістологічно несприятливими вважаються альвеолярна і анапластична або мономорфная круглоклеточная пухлини (табл. 70-4). Гістологічний характер пухлини, який визначається при постановці діагнозу, враховується в сучасних лікувальних програмах і визначає модифікації методів лікування, зокрема інтенсивність терапії.
Таблиця 70-4. Гістологічні типи рабдоміосаркоми

Ембріональні пухлини. Ембріонально-клітинні пухлини складаються з невеликих, округлих, веретеноподібних міобластів. Даний тип клітин зазвичай зустрічається в сечостатевому тракті, а також в області голови та шиї. Це найбільш частий тип клітин, що спостерігається у дітей з рабдоміосаркома (рис. 70-5).
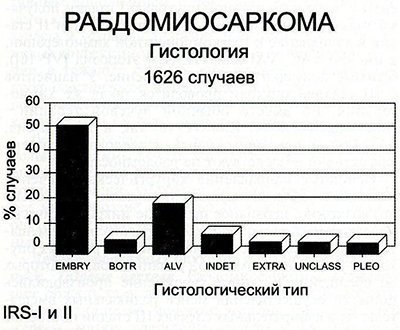
Мал. 70-5. Розподіл пухлин за гістологічною очах у 1626 пацієнтів з Intergroup Rhabdomyosarcoma Study. Ембріональний тип був найчастішим - 54%. Альвеолярні пухлини відзначалися в 21% випадків. (EMBRY - ембріональна, BOTR - ботріоідние, ALV - альвеолярна, INTED - невизначена, EXTRA - пухлина Юінга внекостного, UNCLASS - що не вкладається в класифікацію, PLEO - поліморфний).
Більше 60% випадків, за нашими даними, відноситься до ембріональних пухлин. Невеликі округлі клітини іноді важко диференціювати з лімфоцитами, Нейробласти і з внекостного саркомою Юінга, особливо при дослідженні заморожених зрізів. Діти з ембріональними пухлинами мають найкращий прогноз. Ботріоідние варіант ембріональної рабдоміосаркома відзначається при субмукозной локалізації.
Потім ці пухлини ростуть в просвіт органа і виглядають при макроскопічному дослідженні у вигляді поліпоїдних мас, що нагадують грона винограду. Ботріоідние пухлини зустрічаються в сечовому міхурі, піхві, матці, носоглотці, а також іноді в загальному жовчному протоці і на промежині. На ботріоідние пухлини доводиться 5-6% всіх рабдоміосарком у дітей. Прогноз при цьому дуже сприятливий.
Пухлини, гістологічно несприятливі. Несприятливі форми включають в себе альвеолярні, анапластические і мономорфні круглоклітинна пухлини. На альвеолярную рабдоміосаркому припадає 20% всіх випадків рабдоміосаркоми у дітей. Цей тип росте у вигляді тяжів з гронами невеликих круглих пухлинних клітин з рясною еозинофільної цитоплазмою.
Рабдоміобласти мають поперечну смугастість (40%) і іноді утворюють сінтіціальний багатоядерні гігантські клітини. Однак наявність поперечної смугастість - зовсім не обов'язкова умова для постановки діагнозу. У дітей з альвеолярно-клітинними пухлинами спостерігається хромосомная транслокация між хромосомами 2 і 13. Найбільш часта локалізація - кінцівки, тулуб і перианальная область. Однак альвеолярні пухлини спостерігаються також в зонах, характерних для первинної локалізації рабдоміосарком.
У пацієнтів з альвеолярними пухлинами відзначаються найгірший прогноз, високий відсоток залучення регіональних лімфовузлів, рецидивів пухлини, ураження кісткового мозку і віддалених метастазів. Анапластичний тип характеризується наявністю гіперхроматіческіх і поліморфних ядер зі збільшеними химерними мітотичними фігурами. Мономорфні круглоклітинна пухлини представляють собою поразку з дуже однорідними круглими ядрами з виступаючими краями.
Хоча описані типи пухлини в даний час добре відомі і не менш добре розпізнаються, однак в 10-15% випадків точний тип клітин визначити не вдається, бо він «розпливчастий». Електронна мікроскопія, імуногістохімічні методи, ДНК флоуцітометрія і специфічні целлюлярной протоонкогенах дослідження можуть допомогти з'ясувати походження пухлинних клітин, а відповідно краще зрозуміти залежність виживаності від гістологічного виду пухлини.
Променева терапія. У ранньому досвіді IRS-I у більшості дітей з рабдоміосаркома застосовувалися дози опромінення в 6000 Р, при цьому досягалося лікування 85-90% локальних пухлин. На жаль, подібні результати супроводжувалися неприйнятно високою частотою небажаних віддалених наслідків, таких як «мікротаз», затримка росту скелета, ураження центральної нервової системи і розвиток вторинних пухлин, часто в зоні опромінення.
Лікування в подальшому (IRS-II і III) більш низькими дозами (від 4000 до 5500 сГр в залежності від віку - менше або більше 6 років; лише деякі пацієнти отримували менше 4000 сГр) призвело до збільшення частоти локальних і регіональних рецидивів (більш, ніж в 30% випадків в групах II і III і більше 40% в групі IV), особливо якщо розміри первинної пухлини були значними (> 5,0 см). Виняток становили діти, в тому числі і грудні, з поразкою I групи, у яких пухлина була повністю резецировать. У цих пацієнтів відзначалася висока виживаність при лікуванні двома хіміопрепаратами (актиноміцин D і вінкристин), променева терапія при цьому не була потрібна.
Однак у важких випадках (групи II і IV) променева терапія є дуже важливим компонентом лікування, особливо при такій локалізації, яка не дозволяє провести локальну велику резекцію пухлини. При правильному застосуванні променева терапія сприяє зниженню частоти локальних рецидивів в зоні розташування первинної пухлини. Пацієнти лікувалися методом гіперфракціонного опромінення із застосуванням двічі в день (з проміжком між сеансами в 6-8 годин) дози 110 сГр протягом 5 днів в тиждень.
Теоретичним перевагою гіперфракціонного методу є можливість застосування відповідної дози (5800 сГр) таким чином, що в результаті лікування знищується пухлина, але зберігаються інтактними нормальні тканини. Мета подібної тактики - підвищити відсоток лікування локальних і регіональних пухлин на 10-15%, в той же час зменшивши ризик небажаних пізніх ефектів, пов'язаних з опроміненням.
При деяких локалізаціях може знадобитися ще більше істотне зменшення дози опромінення (наприклад, при опроміненні легких - 1800 сГр, живота-3000 сГр). Зміна схеми і дози опромінення часом необхідно і в тих випадках, коли застосовуються радіопотенціірующіе хіміотерапевтичні препарати, такі як актиноміцин D і адриамицин.
У лікуванні пацієнтів з мягкотканное саркомами іноді застосовується брахітерапії з різним ступенем успіху. Застосування інтерстиціальних датчиків (beads або rods) в піхву, сечовому міхурі та інших місцях (наприклад, скелетні м'язи) забезпечує високу виживаність в деяких випадках, особливо при дуже великих пухлинах, з хорошим локальним ефектом в зоні первинної пухлини.
Брахітерапія володіє наступними перевагами: (1) при даній дозі опромінення збільшується біологічний ефект; (2) безпосередньо візуалізується ложе пухлини; (3) більше можливостей для збереження інтактними навколишніх тканин; (4) можливо здійснити коротку по тривалості опромінення і (5) метод може бути застосований в якості доповнення до звичайного зовнішнього опромінення. Головний недолік брахітерапії - підвищена частота ранових ускладнень.
К.У. Ашкрафт, Т.М. Холдер