Оксиди і кислоти фосфору. Фосфор утворює три з'єднання з киснем: Р2 O3 - фосфористий ангідрид, P2 O5 - фосфорний ангідрид і чотириокис фосфору Р2 O4.
Фосфористий ангідрид Р2 O3 виходить при повільному окисленні фосфору або в тому випадку, коли фосфор згорає при недостатньому доступі кисню. Це біла кристалічна речовина, плавиться при 23,8 ° і кипляче при 173 °. Молекулярний вага його при низьких температурах відповідає формулі Р4 O6. При дії холодної води фосфористий ангідрид повільно з'єднується з нею, утворюючи фосфористу кислоту Н3РО3. Як фосфористий ангідрид, так і фосфористая кислота володіють сильними відновними властивостями.
Фосфорний ангідрид Р2 ПРО5 утворюється при горінні фосфору на повітрі або в кисні у вигляді білої об'ємистої »снегообразной маси, що плавиться при 563 °. Щільність його пара відповідає формулі Р4 О10.
Фосфорний ангідрид жадібно з'єднується з водою і тому застосовується як хороше водоотнимающее засіб. Він може навіть віднімати елементи води від інших з'єднань, наприклад від сірчаної та азотної кислот. На повітрі фосфорний ангідрид, притягаючи вологу, швидко розпливається, перетворюючись в липку масу метафосфорной кислоти.
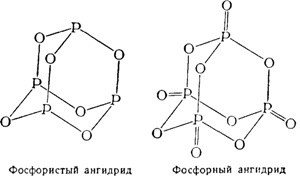
Будова молекул фосфористого і фосфорного ангідридів може бути висловлене такими структурними формулами:
Чотириокис фосфору Р2 О4 є безбарвні блискучі кристали. Цей оксид, подібно N2 О4 можна розглядати як змішаний ангідрид. При розчиненні його у воді утворюються еквімолекулярние кількості фосфорної і фосфористої кислот:
Фосфорні кислоти. Фосфорний ангідрид в залежності від температури може приєднувати різну кількість води, утворюючи мета-, піро- і ортофосфорну кислоти:
При розчиненні фосфорного ангідриду в холодній воді утворюється метафосфорная кислота, найпростіша формула якої НРО3; дійсний же склад її молекул виражається формулою (НРО3) х, де х = 3, 4, 5, 6 і т. д. При випаровуванні розчину метафосфорная кислота виділяється у вигляді склоподібної маси, легко розчинної у воді.
Метафосфорная кислота дуже отруйна. Солі метафосфор-ної кислоти застосовуються для пом'якшення води.
Якщо кип'ятити розчин метафосфорной кислоти, то відбувається приєднання до неї молекул води і утворюється триосновна ортофосфорна кислота Н3 РО4.
Ортофосфорна кислота Н3 РО4 утворює безбарвні прозорі кристали, що плавляться при 42 °. У воді вона розчиняється дуже добре.
Ортофосфорна кислота не отруйна.
При нагріванні ортофосфорної кислоти в сухому вигляді до 215 ° з кожних двох її молекул відщеплюється одна молекула води і виходить чотирьохосновним пірофосфорна кислота у вигляді розчинної у воді склоподібної маси:
З трьох названих кислот найбільше значення має ортофосфорна кислота, яку зазвичай і мають на увазі, коли говорять про фосфорної кислоти.
Ортофосфорна кислота може бути отримана не тільки кип'ятінням розчину метафосфорной кислоти, але й окисленням червоного фосфору азотною кислотою:
Для технічних цілей ортофосфорну кислоту отримують переважно дією сірчаної кислоти на фосфат кальцію:
Утворений сульфат кальцію майже не розчиняється у воді, тому розчин фосфорної кислоти легко може бути відділений від нього і згущений виправними.
Фосфорна кислота є кислотою середньої сили. Її первинна константа дисоціації дорівнює 7,5 • 10 -3. У водному розчині фосфорна кислота дисоціює переважно на іони Н • і Н2 РО4 '
Як кислота триосновна, ортофосфорна кислота утворює три ряди солей: нормальні солі, кислі солі з одним атомом водню в кислотному залишку і кислі солі з двома атомами водню в кислотному залишку. Нормальні солі фосфорної кислоти називаються фосфатами, кислі - гідрофосфат.
Всі первинні фосфати розчиняються у воді; з вторинних ж і третинних розчинні лише фосфати натрію, калію і амонію.