
Головна | Про нас | Зворотній зв'язок
Атом хлору, як відомо, має негативний індуктивним ефектом і позитивним мезомерним ефектом, причому -I-ефект перевищує + М-ефект. Таким чином, хлор є електроноакцептором і ускладнює перебіг реакцій електрофільного заміщення. Тому нітрація хлорбензолу протікає в 7-8 разів повільніше, ніж нітрація бензолу. Проте швидкість реакції виявляється досить великий, і процес організовують безперервним способом з використанням каскаду трьох або чотирьох реакторів. Починають нітрація при 20-40 о С (перший реактор), а закінчують - при 70-80 о С (останній реактор). З останнього реактора реакційна маса надходить в фазоразделітель, де відбувається відділення відпрацьованої кислоти (нижній шар) від органічного шару (верхній шар). Суміш нітрохлорбензоли промивають послідовно водою, розчином соди і знову водою, сушать у вакуумі, а потім направляють на розділення, яке грунтується на відмінності в хімічних властивостях мононітрохлорбензолів.
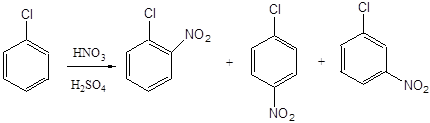
близько 30% близько 70% до 1.5%
Практичне значення з трьох ізомерних нітрохлорбензоли мають пара- і орто-ізомери, в яких атом хлору перебувати в активованому нітрогрупою положенні і може бути легко замінений на різні угруповання в результаті нуклеофільних реакцій. Таким чином з п-нітрохлорбензола можуть бути отримані п-нитрофенол, п-нітрофенетол, п-нітроанізол, п-нітроанілін, різні похідні дифениламина і дифеніловий ефіру. Нітрогрупа в зазначених вище з'єднаннях (за винятком п-нітроаніліна) в подальшому може бути відновлена до аміногрупи. Як приклади можуть бути запропоновані наступні схеми:
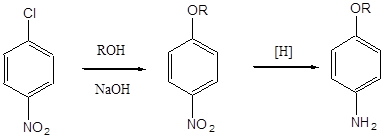
R = H п-нитрофенол п-аминофенол
R = OCH3 п-нітроанізол п-анізідін
R = OC2 H5 п-нітрофенетол п-фенетидину
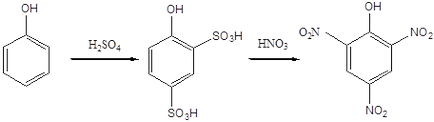
Атом хлору в 2,4-дінітрохлорбензоле також може бути легко замінений на різні угруповання в результаті нуклеофільних реакцій. Зокрема, при дії водного розчину лугу (їдкий натр) або аміаку отримують 2,4-динитрофенол і 2,4-дінітроанілін. За однією з технологій з 2,4-динитрофенола в результаті нітрування може бути отримана пікринова кислота.
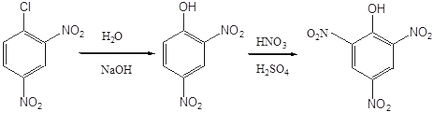
Пікринова кислота. т.пл. 122-122.5 про С. Вибухає при детонації в контакті з металами і їх оксидами, застосовується у виробництві азобарвників, бризантних вибухових речовин, для ідентифікації різних органічних сполук. Є сильною кислотою, яку можна порівняти з мінеральними кислотами. Солі пікринової кислоти називаються ПІКРАТ. У вигляді ПІКРАТ виділяють різні нестійкі органічні сполуки основного характеру.
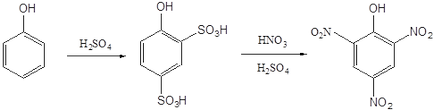
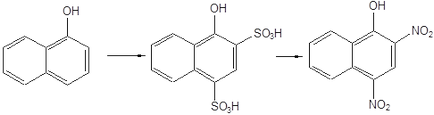
Аналогічним чином з 1-нафтола отримують 1-гідрокси-2,4-дінітронафта-лін.
Аміногрупа є ще більш сильним електронодонорності заступником, ніж гідроксигрупа. У той же час сама аминогруппа легко окислюється. Тому пряме нітрування ароматичних амінів виявляється неможливим. У зв'язку з цим аминогруппу попередньо захищають. Зазвичай для захисту використовують ацетильную або тозільную групу. В N-ацільних- або N-тозільних похідних ароматичних амінів основність аміногрупи в помітному ступені знижена. Нітрування цих сполук протікає переважно в пара-положення до захищеної аминогруппе. Захисна угруповання в нітропродукте в подальшому може бути знята в результаті основного або кислотного гідролізу. Як приклад може бути представлена схема отримання 2-метокси-4-нітроаніліна.