Якщо відкритий стакан з водою залишити на довгий час, то в кінці кінців вода повністю випарується. Точніше випарується. Що таке випаровування і чому воно відбувається?
2.7.1 Випаровування і конденсація
При даній температурі молекули рідини мають різними швидкостями. Швидкості більшості молекул знаходяться поблизу деякого середнього значення (характерного для цієї температури). Але трапляються молекули, швидкості яких значно відрізняються від середньої як в меншу, так і б'ольшую сторону.
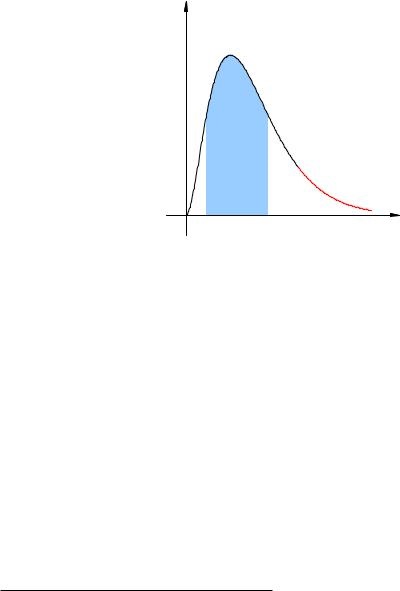
На рис. 2.16 зображений приблизний графік розподілу молекул рідини за швидкостями. Блакитним фоном показано те саме більшість молекул, швидкості яких групуються біля середнього значення. Червоний ¾хвост¿ графіка це невелике число ¾бистрих¿ молекул, швидкості яких істотно перевищують середню швидкість основної маси молекул рідини.
Мал. 2.16. Розподіл молекул за швидкостями
Коли така вельми швидка молекула опиниться на вільної поверхні рідини (т. Е. На кордоні розділу рідини і повітря), кінетичної енергії цієї молекули може вистачити на те, щоб подолати сили тяжіння інших молекул і вилетіти з рідини. Даний процес і є випаровування, а молекули, що покинули рідина, утворюють пар.
Отже, випаровування це процес перетворення рідини в пару, що відбувається на вільної поверхні рідини 7.
Може трапитися, що через деякий час молекула пара повернеться назад в рідину.
Процес переходу молекул пари в рідину називається конденсацією. Конденсація пара процес, зворотний випару рідини.
2.7.2 Динамічна рівновага
А що буде, якщо посудина з рідиною герметично закрити? Щільність пара над поверхнею рідини почне збільшуватися; частинки пара будуть все сильніше заважати іншим молекулам рідини вилітати назовні, і швидкість випаровування стане зменшуватися. одночасно почне
7 При особливих умовах перетворення рідини в пару може відбуватися по всьому об'єму рідини. Даний процес вам добре відомий це кипіння.
збільшуватися швидкість конденсації, так як зі зростанням концентрації пара число молекул, які повертаються в рідину, ставатиме все більше.
Нарешті, в якийсь момент швидкість конденсації виявиться дорівнює швидкості випаровування. Настане динамічна рівновага між рідиною і парою: за одиницю часу з рідини буде вилітати стільки ж молекул, скільки повертається в неї з пара. Починаючи з цього моменту кількість рідини перестане зменшуватися, а кількість пара збільшуватися; пар досягне ¾насищенія¿.
Насичена пара це пар, який знаходиться в стані динамічної рівноваги зі своєю рідиною. Пар, який не досяг стану динамічної рівноваги з рідиною, називається ненасиченим.
Тиск і щільність насиченого пара позначаються p н і н. Очевидно, p н і н це максимальні тиск і щільність, які може мати пар при даній температурі. Іншими словами, тиск і щільність насиченого пара завжди перевищують тиск і щільність ненасиченого пара.
2.7.3 Властивості насиченої пари
Виявляється, що стан насиченої пари (а ненасиченого тим більше) можна наближено описувати рівнянням стану ідеального газу (рівняння Менделєєва Клапейрона). Зокрема, маємо наближене співвідношення між тиском насиченої пари і його щільністю:
Це досить дивний факт, який підтверджується експериментом. Адже за своїми властивостями насичений пар істотно відрізняється від ідеального газу. Перерахуємо найважливіші з цих відмінностей.
1. При незмінній температурі щільність насиченого пара не залежить від його обсягу.
Якщо, наприклад, насичений пар ізотермічні стискати, то його щільність в перший момент зросте, швидкість конденсації перевищить швидкість випаровування, і частина пара конденсується в рідину до тих пір, поки знову не наступить динамічна рівновага, в якому щільність пара повернеться до свого колишнього значення.
Аналогічно, при ізотермічному розширенні насиченої пари його щільність в перший момент зменшиться (пар стане ненасиченим), швидкість випаровування перевищить швидкість конденсації, і рідина буде додатково випаровуватися доти, поки знову не встановиться динамічна рівновага т. Е. Поки пар знову не стане насиченим з колишнім значенням щільності.
2. Тиск насиченої пари не залежить від його обсягу.
Це випливає з того, що щільність насиченого пара не залежить від обсягу, а тиск однозначно пов'язане з щільністю рівнянням (2.6).
Як бачимо, закон Бойля-Маріотта, справедливий для ідеальних газів, для насиченого пара не виконується. Це й не дивно адже він отриманий з рівняння Менделєєва Клапейрона в припущенні, що маса газу залишається незмінною.
3. При незмінному обсязі щільність насиченого пара зростає з підвищенням температури і зменшується зі зниженням температури.
Дійсно, при збільшенні температури зростає швидкість випаровування рідини. Динамічна рівновага в перший момент порушується, і відбувається додаткове
випаровування деякої частини рідини. Пара буде додаватися до тих пір, поки динамічна рівновага знову не відновиться.
Точно так же при зниженні температури швидкість випаровування рідини стає менше, і частина пара конденсується до тих пір, поки не відновиться динамічна рівновага але вже з меншою кількістю пара.
Таким чином, при Ізохоричний нагріванні або охолодженні насиченого пара його маса змінюється, тому закон Шарля в даному випадку не працює. Залежність тиску насиченої пари від температури вже не буде лінійною функцією.
4. Тиск насиченої пари зростає з температурою швидше, ніж за лінійним законом.
Справді, зі збільшенням температури зростає щільність насиченого пара, а відповідно до рівняння (2.6) тиск пропорційно добутку щільності на температуру.
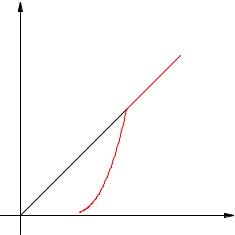
Залежність тиску насиченої пари від температури є експоненціальною (рис. 2.17). Вона представлена ділянкою 1-2 графіка. Цю залежність можна вивести із законів ідеального газу.
Мал. 2.17. Залежність тиску пари від температури
У точці 2 вся рідина випаровується; при подальшому підвищенні температури пар стає ненасиченим, і його тиск зростає лінійно по закону Шарля (ділянка 2-3).
Згадаймо, що лінійне зростання тиску ідеального газу викликаний збільшенням інтенсивності ударів молекул об стінки посудини. У разі нагрівання насиченої пари молекули починають бити не тільки сильніше, але і частіше адже пара стає більше. Одночасною дією цих двох чинників і викликаний експоненціальне зростання тиску насиченої пари.
2.7.4 Вологість повітря
Повітря, що містить водяну пару, називається вологим. Чим більше пара знаходиться в повітрі, тим вище вологість повітря.
Абсолютна вологість це парціальний тиск водяної пари, що знаходиться в повітрі (т. Е. Тиск, яке водяна пара надавав би сам по собі, за відсутності інших газів). Іноді абсолютноювологістю називають також щільність водяної пари в повітрі.
Відносна вологість повітря 'це відношення парціального тиску водяної пари в ньому до тиску насиченої водяної пари при тій же температурі. Як правило, це
відношення виражають у відсотках:
З рівняння Менделєєва-Клапейрона (2.6) випливає, що відношення тисків пара дорівнює відношенню густини. Так як саме рівняння (2.6), нагадаємо, описує насичений пар лише приблизно, ми маємо наближене співвідношення:
Одним з приладів, що вимірюють вологість повітря, є психрометр. Він включає в себе два термометра, резервуар одного з яких загорнутий в мокру тканину. Чим нижче вологість, тим інтенсивніше йде випаровування води з тканини, тим сильніше охолоджується резервуар ¾мокрого¿ термометра, і тим більше різниця його показань і показань сухого термометра. З цієї різниці за допомогою спеціальної психрометричні таблиці визначають вологість повітря.