Молярна маса хлороводню
Хлороводень (хлороводородная кислота, соляна кислота) - складна речовина неорганічної природи, яке може існувати як в рідкому, так і в газоподібному стані.
У другому випадку воно являє собою безбарвний газ, добре розчинний у воді, а в першому - розчин сильної кислоти (35-36%). Будова молекули хлороводню, а також її структурна формула наведені на рис. 1. Щільність - 1,6391 г / л (н.у.). Температура плавлення дорівнює - (-114,0 o С), кипіння - (-85,05 o С).
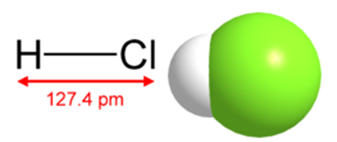
Мал. 1. Структурна формула і просторова будова молекули хлороводню.
Брутто-формула хлороводню - HCl. Як відомо, молекулярна маса молекули дорівнює сумі відносних атомних мас атомів, що входять до складу молекули (значення відносних атомних мас, узятих з Періодичної таблиці Д. І. Менделєєва, округлимо до цілих чисел).
Mr (HCl) = Ar (H) + Ar (Cl);
Mr (HCl) = 1 + 35,5 = 36,5.
Молярна маса (М) - це маса 1 моль речовини. Легко показати, що чисельні значення молярної маси М і відносної молекулярної маси Mr рівні, однак перша величина має розмірність [M] = г / моль, а друга безрозмірна:
Це означає, що молярна маса хлороводню дорівнює 36,5 г / моль.
Молярну масу речовини в газоподібному стані можна визначити, використовуючи поняття про його молярном обсязі. Для цього знаходять обсяг, яку він обіймав при нормальних умовах певної масою даної речовини, а потім обчислюють масу 22,4 л цієї речовини при тих же умовах.
Для досягнення даної мети (обчислення молярної маси) можливе використання рівняння стану ідеального газу (рівняння Менделєєва-Клапейрона):
де p - тиск газу (Па), V - об'єм газу (м 3), m - маса речовини (г), M - молярна маса речовини (г / моль), Т - абсолютна температура (К), R - універсальна газова постійна рівна 8,314 Дж / (моль × К).
Приклади розв'язання задач
В якому із зазначених речовин масова частка елемента кисню більше: а) в оксиді цинку (ZnO); б) в оксиді магнію (MgO)?
Масова частка елемента Х в молекулі складу НХ розраховується за такою формулою:
ω (Х) = n × Ar (X) / M (HX) × 100%.
Розрахуємо масову частку кожного елемента кисню в кожному із запропонованих сполук (значення відносних атомних мас, узятих з Періодичної таблиці Д. І. Менделєєва округлимо до цілих чисел).
Знайдемо молекулярну масу оксиду цинку:
Mr (ZnO) = Ar (Zn) + Ar (O);
Mr (ZnO) = 65+ 16 = 81.
Відомо, що M = Mr, значить M (ZnO) = 81 г / моль. Тоді масова частка кисню в оксиді цинку буде дорівнює:
ω (O) = Ar (O) / M (ZnO) × 100%;
ω (O) = 16/81 × 100% = 19,75%.
Знайдемо молекулярну масу оксиду магнію:
Mr (MgO) = Ar (Mg) + Ar (O);
Mr (MgO) = 24+ 16 = 40.
Відомо, що M = Mr, значить M (MgO) = 60 г / моль. Тоді масова частка кисню в оксиді магнію дорівнюватиме:
ω (O) = Ar (O) / M (MgO) × 100%;
ω (O) = 16/40 × 100% = 40%.
Таким чином, масова частка кисню більше в оксиді магнію, оскільки 40> 19,75.
Масова частка елемента Х в молекулі складу НХ розраховується за такою формулою:
ω (Х) = n × Ar (X) / M (HX) × 100%.
Розрахуємо масову частку кожного елемента кисню в кожному із запропонованих сполук (значення відносних атомних мас, узятих з Періодичної таблиці Д. І. Менделєєва округлимо до цілих чисел).
Знайдемо молекулярну масу оксиду алюмінію:
Mr (Al2 O3) = 2 × 27 + 3 × 16 = 54 + 48 = 102.
Відомо, що M = Mr, значить M (Al2 O3) = 102 г / моль. Тоді масова частка алюмінію в оксиді буде дорівнює:
ω (Al) = 2 × Ar (Al) / M (Al2 O3) × 100%;
ω (Al) = 2 × 27/102 × 100% = 54/102 × 100% = 52,94%.
Знайдемо молекулярну масу оксиду заліза (III):
Mr (Fe2 O3) = 2 × 56 + 3 × 16 = 112 + 48 = 160.
Відомо, що M = Mr, значить M (Fe2 O3) = 160 г / моль. Тоді масова частка заліза в оксиді буде дорівнює:
ω (O) = 3 × Ar (O) / M (Fe2 O3) × 100%;
ω (O) = 3 × 16/160 × 100% = 48/160 × 100% = 30%.
Таким чином, масова частка металу більше в оксиді алюмінію, оскільки 52,94> 30.