Механізми розвитку (патофізіологія) реперфузії інфаркту міокарда
Далі розглянуті втручання, спрямовані на обмеження розмірів інфаркту за рахунок збереження міокарда, ще не зазнала некротичних змін.
Найбільш ефективний спосіб збереження міокарда, яке постраждало внаслідок інфаркту. - якомога більш раннє відновлення коронарного кровотоку. Цей процес називають реперфузією. У більшості випадків вона може викликати небажані ускладнення, включаючи аритмію, крововиливи з смугами пересокращенія кардіоміоцитів, необоротне пошкодження клітин, накладають на початкове ішемічне ураження (реперфузійного пошкодження), мікросудинні пошкодження і тривалу ПІСЛЯІШЕМІЧНИЙ дисфункцію (стан, або «приголомшений» міокард).
У спробі розчинити, механічно зруйнувати або обійти область пошкодження при гострому ІМ часто виконують втручання на коронарних судинах (наприклад, тромболізис, ангіопластику, стентування або коронарне шунтування). Мета цих втручань - відновити кровотік в зоні ризику розвитку інфаркту та зберегти ішемізованих (але ще не некротизований) міокард. Оскільки міокард після інфаркту продовжує втрачати свою життєздатність, рання реперфузія може врятувати кардіоміоцити і тим самим обмежити область інфаркту з наступним поліпшенням функції міокарда і підвищенням виживаності пацієнтів в найближчий і віддалений періоди.
Потенційна користь реперфузії залежить від двох чинників:
(1) швидкості купірування коронарної обструкції (критичними є перші 3-4 год після її початку);
(2) ступеня корекції судинної оклюзії і поразки, що лежить в її основі.
Наприклад, тромболізис може видалити тромб, окклюзирована коронарну артерію, але не в змозі вплинути на атеросклеротичної бляшки, ініційовану тромбоутворення. Навпаки, черезшкірна транслюмінальна коронарна ангіопластика зі стентуванням не тільки усуває тромботичну окклюзию, але певною мірою усуває первісну обструкцію і нестабільність, обумовлені зруйнованої бляшкою.
Коронарне шунтування забезпечує кровотік в обхід окклюзирована судини.
Нагадаємо, що важка ішемія не викликає негайну клітинну загибель навіть в найбільш уражених областях міокарда і в повному обсязі області міокарда ішемізіруются в рівній мірі. Отже, після відновлення кровотоку результат в різних областях може бути різним. Реперфузія міокарда в межах 20 хв від початку ішемії може повністю запобігти некроз.
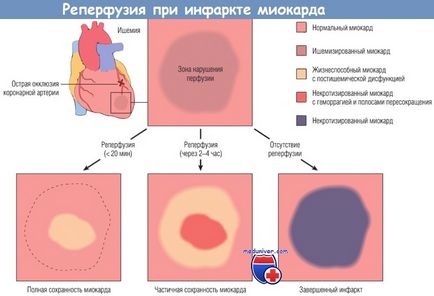
У серці, який зазнав короткочасної (тривалістю не більше 20 хв) ішемії з наступною реперфузією, некроз не розвивається (оборотне ушкодження), але виникає дисфункція міокарда ( «оглушення»).
Якщо коронарна оклюзія триває більше 20 хв, область некрозу з часом поширюється з субендокардіальному зони в субепікардіальному.
Реперфузія в межах 3-6 год від початку ішемії рятує ишемизированную, але життєздатну тканину.
У цій області також може спостерігатися «оглушення» міокарда.
Реперфузія через більше 6 годину значуще не зменшує розмір інфаркту міокарда.
У більш пізні терміни реперфузия вже не в змозі запобігти некроз, проте здатна врятувати хоча б деякі кардіоміоцити.
Типова картина міокарда після реперфузії представлена на малюнку нижче. В області інфаркту зазвичай присутній крововилив, тому що при ішемії судинна стінка пошкоджується і під час відновлення кровотоку кров виходить із судин. Мікроскопічне дослідження показує, що кардіоміоцити, необоротно пошкоджені до моменту реперфузії, часто містять смуги пересокращенія, що представляють собою інтенсивно еозинофільні внутрішньоклітинні вузькі смужки, що складаються з тісно прилеглих один до одного саркомерів.
Смуги пересокращенія виникають внаслідок посиленого скорочення міофібрил, коли перфузія відновлюється. В цей час вміст загиблих клітин з ушкодженою плазматичноїмембраною піддається впливу високої концентрації іонів кальцію, присутніх в плазмі. Таким чином, реперфузія не тільки рятує оборотно пошкоджені клітини, але також змінює морфологію необоротно пошкоджених клітин.
Реперфузія також може надавати несприятливий вплив на ішемізованих міокард (реперфузійного пошкодження). Реперфузійного пошкодження може бути опосередковано окислювальним стресом, надлишком кальцію і запаленням, яке зазвичай виникає під час реперфузії. Індуковані реперфузією мікросудинні пошкодження викликають не тільки геморагії, але і набухання ендотелію, яке призводить до оклюзії капілярів і здатне обмежити реперфузію міокарда, що знаходиться в критичному стані (цей феномен називають невідновлення кровотоку, no-reflow).
Протягом декількох днів або тижнів в кардіоміоцитах, пошкодження яких було попереджено реперфузією, можна спостерігати біохімічні зміни. Припускають, що вони лежать в основі феномена «оглушення» міокарда - стану оборотної серцевої недостатності, яке зазвичай проходить через кілька днів після реперфузії. Реперфузія часто індукує аритмії.
Міокард. піддався хронічної сублетальні ішемії, може впасти в стан глибокого сну, що характеризується зниженням функції і метаболізму. Функцію гібернованого міокарда можна відновити за допомогою реваскуляризації (наприклад, виконавши коронарне шунтування, ангіопластику або встановивши стент). Як це не парадоксально, але повторна короткочасна важка ішемія здатна захистити міокард від інфаркту (феномен, відомий як прекондиціонування, його механізми ще не встановлені).
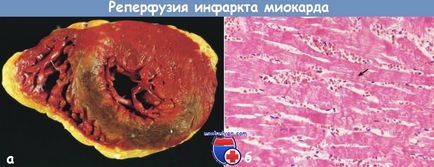
Великий гострий інфаркт передньої стінки лівого шлуночка з геморагій у пацієнта з тромбозом передньої низхідної артерії.
Для лікування застосовували фібринолітичний агент стрептокиназу (зріз серця забарвлений хлоридом тріфенілтетразолій). Орієнтація препарату: задня стінка серця вгорі. б - мікроскопічна картина міокарда після реперфузії. Некроз міокарда з геморагій і смугами пересокращенія, які видно як темні смужки, що перетинають деякі міофібрили (стрілка).
Це характерна картина міокарда, яка зазнала вираженою ішемії, після реперфузії.
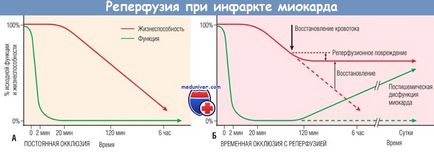
Після коронарної оклюзії скорочувальна функція втрачається протягом 2 хв, а життєздатність починає знижуватися через 20 хв.
(А) Якщо перфузия не відновлюється, то майже всі кардіоміоцити в ураженій зоні загинуть.
(Б) У разі відновлення кровотоку некроз в тій чи іншій мірі запобігається, міокард не гине і принаймні частково його функції відновлюються.
Ньому раніше відбувається реперфузия, тим більше кардіоміоцитів залишаться збереженими.
Процес реперфузии здатний індукувати певні ускладнення (реперфузійного пошкодження),
і відновлення функції врятованого міокарда затримується на кілька годин або діб (ПІСЛЯІШЕМІЧНИЙ дисфункція міокарда).
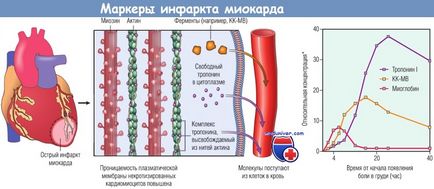
Деякі з цих білків, наприклад тропоніни I, С або Т і MB-фракція креатинкінази (КК-МВ), служать діагностичними біомаркерами.
* Сукупність верхніх референсних значень.