Зонка (тисячу вісімсот сімдесят дев'ять ᴦ.), Чермак, Шенфліса, Федоров (1891 ᴦ.) Та інші показали геометрично, що вс ?? е кристалічні форми можна уявити як результат распредел ?? ення точок (найдрібніших віщо-ських частинок) в просторі за законами симетрії ; отримую-щіеся конфігурації вони назвали кристалічними гратами.
Розподіляючи згідно елементам симетрії точки у просторі стве, вони отримали 230 комбінацій, 230 кристалічних решіток, які відповідають нд ?? їм зустрічаються в природі кристали-ного формам.
Подальше дослідження кристалів за допомогою променів Рент-гена німецьким вченим Лауе (1912 ᴦ.) Підтвердило ті припущень-ня і висновки, які були зроблені непрямим шляхом. Були по-лучени прямі докази існування атомів, іонів і спо-собів їх розташування в просторі.

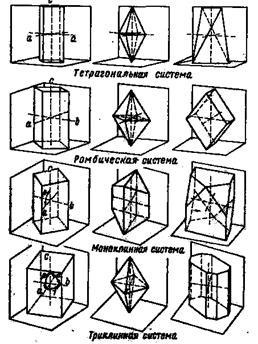
Рис.6. Схематичне зображення ос ?? їй кристалів і граней
Кристалічні решітки, як з'ясувалося, діляться на слідую щие групи: атомні, іонні, молекулярні і металеві.
Атомні решітки. Кожне вузлове місце в атомній решітці зайнято нейтральним атомом. Прикладом може служити кристали-чна решітка аргону, наведена на малюнку 7.
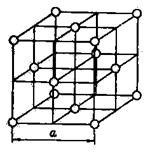
Мал. 7. Кристалічні ґрати аргону
Іонні решітки. Кожне вузлове місце в іонної решітці за-нято іоном. Приклади іонних решіток наведені на малюнках 8 і 9. На рис. 8, а показана кристалічна решітка Na + Cl -. на рис. 8,6 - решітка CsJ; на рис. 9 приведена кристалічна решітка CaF2.
Кристалічна решітка Na + Cl - типова для бінарних елек-тролітов, складається з двох зосереджених в гранях решіток, вдві-нутих одна в іншу на ½ довжини ребра куба. Одна решітка - ка-ції Na +. інша така ж-аніону С1 -.
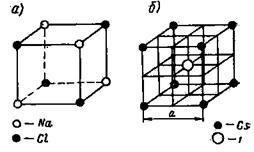
Мал. 8. Кристалічні ґрати NaCl і CsJ
Кристалічна решітка Cs + J - являє собою поєднання двох простих кубічних грат: решітки іона Cs + і решітки іона J -. всунути одна в іншу так, що в центрі куба знаходиться іон йоду, а в кутах - іони Cs +. Ці грати центрована в про-просторі так, що в центрі куба знаходиться аніон, а в кутах -ка-ції.
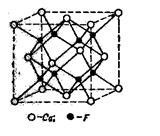
Мал. 9. Кристалічні ґрати CaF2
Кристалічна решітка Ca 2+ F2 - типова для багатьох потрійних електролітів. Тут іони Са 2+ утворюють кристалічну, центри-рованную в гранях, грати, іони ж F - розташовані в середи-нах восьми маленьких кубів, на які повинна бути розкладений великий куб.
В іонних кристалічних решітках окремі місця можуть за-розуміти складні і комплексні іони. Приклади: решітка нітрату натрію Na + NO3 - (мал 9, а) і решітка гексахлороплатіната калію K + [PtCl6] 2- (рис. 10, б). Тут окремі місця займають іони: Na +. До +. NO3 -. [PtCl6] 2.
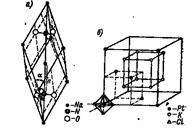
Мал. 10. Кристалічні ґрати нітрату натрію і гексахлороплатіната калію.
У кристалічній решітці нітрату натрію кожен іон NO3 - займає одне місце, причому в центрі тетраедра - атом азоту N +5. а в кутах - атоми кисню О; атоми зближені один з одним і складають міцну, міцно стягнуту групу.
Таку ж групу представляє собою міцний комплексний іон [PtCl6] 2. Просторово він побудований так: в центрі октаедра - іон Pt 4+. а в кутах - іони С1 -.
Іони [PtCl6] 2 займають кути кубічної, центрованої в гранях, кристалічної решітки. Іони К + складають куб.
Молекулярні решітки. У молекулярних решітках окремі місця займають молекули. Прикладом молекулярних решіток з'єдн ?? ень, які розглядаються в неорганічної хімії, можуть служити кристалічні решітки окису алюмінію (рис. 11, а) і двоокису вуглецю СО2 (рис. 11,6). У кристалічній решітці окислу алюмінію Аl2 Оз кути ромба з довжиною ребра # 945; o = 5,12А займають близько розташовані один до одного групи атомів, що утворюють нейтральну молекулу.
У кристалічній, центрованої в гранях, решітці двоокису вуглецю окремі місця займають нейтральні молекули СО2. дуже зближені групи з трьох атомів С і 2О, згруповані так, як це показано на рис.11.
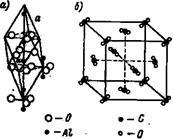
Мал. 11. Кристалічні ґрати окису алюмінію і двоокису вуглецю СО2
Металеві решітки. Металеві грати характери-ся особливими властивостями, що відрізняють їх від інших типів кристалічних решіток. У вузлах металевих решіток знаходяться не атоми, а позитивні іони. Зовнішні електрони атомів металів вільно мігрують всередині кристалічної решітки, пере-ходячи від одного іона до іншого, т. Е. Поводяться подібно молекулами-лам газу, в зв'язку з цим всю сукупність електронів в кристалічній решітці металів називають електронним газом.
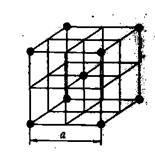
Мал. 12. Кристалічні ґрати металевого натрію
Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, металеву решітку можна розглядати як іонну грати, що знаходиться в''атмосфере'' електронного газу з зовнішніх електронів. Така, наприклад, решітка металевого натрію (рис. 12). Характерні властивості металів - електропровідність і теплопровідність, зокрема, залежать від пересування електро-нів всередині решітки. Під впливом зовнішнього електричного поля валентні електрони, число яких у атомів металів невелика (1, 2 або 3), переміщаються в напрямку поля, створюючи електричну провідність.
Для виготовлення обладнання в різних від-галузях сучасної промисловості використовуються самі різно-образні матеріали, як природні, так і створені руками людини. При цьому основа сучасної техніки - машини і меха-нізми - виготовляються в основному з металевих матеріалів - металів, сплавів металів один з одним і з не-якими неметаллами, перш нд ?? його з вуглецем. Це пов'язано з тим, що з нд ?? ех видів матеріалів металеві матеріали володіють найбільш цінними механічними властивостями. Разом з тим, металеві матеріали дуже численні і разнооб-різні за своїми властивостями.

У рідкому стані більшість металів розчиняються один в одному і утворюють однорідний рідкий сплав. При кристалів-зації з розплавленого стану різні метали поводяться по-різному. Основними випадками є при цьому наступні:
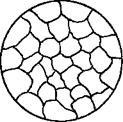
1. У твердому стані сплавляли метали не розчиняються і хімічно не взаємодіють один з одним. При цих умовах сплав представляє собою механічну суміш і складається з кри-сталлітов одного і іншого компонентів, чітко виявляються на мікрошліф (рис. 13).
2. сплавляли метали взаємодіють один з одним, обра-чаплі хімічне з'єдн ?? ення.
3. При кристалізації з розплаву розчинність металів один в одному зберігається. Утворюються однорідні кристали. В цьому випадку тверда фаза носить назву твердого розчину (рис. 14). При цьому для одних металів їх взаємна розчинність в твердому стані необмежена, інші ж рас-яка твориться один в одному лише до определ ?? енних концентрацій.
Читайте також
Метали звичайного способу виробництва мають кристалічну будову. Вкрісталлахатоми розташовані строго впорядкованим чином так, що, якщо через їх центри провести уявні лінії уздовж трьох координатних осей, вони утворюють просторову (кристалічну). [Читати далі].
Металева зв'язок обумовлена зниженням енергії кристала через повну колективізації електронів зовнішніх s і частково p - оболонок. Воднева зв'язок обумовлена гібридизацією електронів атома водню з електронегативними атомами. [Читати далі].
Зонка (1879 г.), Чермак, Шенфліса, Федоров (1891 г.) та інші показали геометрично, що все кристалічні форми можна уявити як результат розподілу точок (найдрібніших віщо-ських частинок) в просторі за законами симетрії; отримую-щіеся конфігурації вони назвали. [Читати далі].
Метали звичайного способу виробництва мають кристалічну ладі- ня. У кристалах атоми розташовані строго впорядкованим чином так, що, якщо через їх центри провести уявні лінії уздовж трьох коорди- кімнатній осей, вони утворюють просторову. [Читати далі].