Лабораторна робота 11
Комплексним називається з'єднання, в вузлах кристалічної решітки якого знаходяться комплексні іони, здатні до самостійного існування в розчинах. Наприклад, K2 [HgI4], [Cu (NH3) 4] Cl2.
Такі складні речовини утворюються в результаті з'єднання нейтральних молекул без виникнення нових електронних пар:
Згідно координаційної теорії Вернера один атом в комплексному іоні (зазвичай позитивно заряджений) виконує роль центрального атома (комплексоутворювача). Навколо нього координується деяке число аніонів або нейтральних молекул - лігандів, які разом з центральним атомом утворюють внутрішню сферу комплексної сполуки або комплексний іон. У формулах комплексний іон (координаційна сфера) виділяється квадратними дужками. Інші іони утворюють зовнішню сферу комплексної сполуки. Так, в K2 [HgI4] Hg 2+ - комплексоутворювач; іони I - - ліганди; іони K + - зовнішня сфера.
Комплексний іон може містити одночасно різнорідні ліганди. У комплексі [Co (NH3) 3 (H2 O) 2 Cl] 2+ лигандами є молекули NH3. H2 O і іон Cl -.
Число лігандів, що оточують комплексообразователь, називається координаційним числом (к.ч.) цього комплексообразователя, наприклад:
Часто, але не завжди координаційне число дорівнює подвоєному заряду комплексоутворювача. Координаційне число для багатьох комплексообразователей не є постійним.
Заряд комплексного іона дорівнює алгебраїчній сумі зарядів комплексоутворювача і лігандів. Так, до складу іона [Fe (CN) 6] x входять комплексообразователь Fe 2+ і ліганди - іони CN -; тому x = + 2 + 6 (-1) = -4. У іон [Co (NH3) 4 Cl2] x входять комплексообразователь Co 3+ і ліганди - молекули NH3 (вони заряду не мають) і іони Cl -. тому x = + 3 + 4 (0) +2 (-1) = +1.
Більшість комплексних сполук є електролітами і в розчинах дисоціюють на комплексні іони і іони зовнішньої сфери (первинна дисоціація):
Комплексні іони в розчині в тій чи іншій мірі можна зупинити диссоциируют на комплексоутворювач і ліганди (вторинна дисоціація):
Константи рівноваги процесів вторинної дисоціації називаються константами нестійкості Кн комплексного іона:
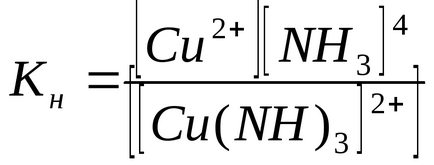
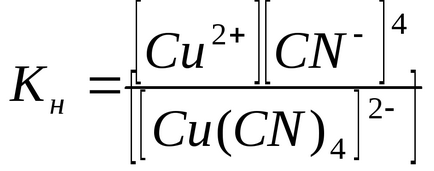
Величина Кн визначає міцність комплексного іона: чим вона менша, тим більше стійкий комплексний іон. З наведених даних видно, що комплексний іон [Cu (CN) 4] 2- значно міцніше іона [Cu (NH3) 4] 2+.
Посилити дисоціацію комплексного іона і навіть зруйнувати його можна нагріванням, розведенням, додаванням речовин, які з одним з компонентів комплексного іона утворюють ще менш диссоциирующие молекули і іони. Наприклад, комплексний іон [Ag (NH3) 2] + (Кн = 6,8 ∙ 10 -8) можна зруйнувати додаванням іонів Ni 2+. так як іон Ni 2+ утворює з молекулами аміаку міцніший комплексний іон [Ni (NH3) 6] 2+ (Кн = 2,0 ∙ 10 -9):
Додавання сильної кислоти до комплексних іонів, що містить молекули NH3. призводить до їх руйнування. Іони водню кислоти з молекулами NH3 утворюють міцніші іони NH4 +:
Комплексні сполуки, які у водних розчинах майже повністю розпадаються на прості іони і молекули, називаються подвійними солями. Так, подвійна сіль KFe (SO4) 2 диссоциируют за рівнянням:
і все іони, що утворилися в розчині, можна виявити відповідними реакціями. Формули подвійних солей записують без квадратних дужок: NaAl (SO4) 2. KMgCl3.
Мета роботи - ознайомитися з основними способами отримання і деякими хімічними властивостями комплексних сполук.
Устаткування і матеріали: штатив із пробірками.
Реактиви: магній порошок, лакмусовий папірець, універсальна індикаторна папір, фільтрувальний папір; розчини: сульфату алюмінію, гідроксиду натрію (1-2 н. Конц.), Сульфату міді, гідроксиду амонію конц. залізо-амонійних квасцовNH4Fe (SO4) 2, роданида аммоніяNH4NCS, хлориду барію, хлориду натрію, нітрату срібла, азотної кислоти (1-2 н.), сульфату нікелю.
Досвід 1. Отримання з'єднань з комплексним аніоном (комплексної сполуки алюмінію)
У пробірку з 5 краплями розчину Al2 (SO4) 3 доливати по краплях розчин їдкого натру (NaOH). Утворений осад Al (OH) 3 розчинити, додаючи до осаду надлишок лугу. Скласти молекулярні та іонні рівняння реакцій утворення гідроксиду алюмінію і тетрагідроксоалюміната натрію. Написати вираз для константи нестійкості комплексного іона.
Досвід 2. Отримання з'єднань з комплексним катіоном (аміакати міді)
До концентрованого розчину сульфату міді CuSO4 (досить 5 крапель) доливати концентрований розчин аміаку спочатку до утворення блакитного осаду гідроксосульфата міді, потім до повного його розчинення (утворення розчину синього кольору). Написати молекулярні та іонні рівняння реакцій, відповідних перетворень:
Написати вираз для константи нестійкості комплексного іона.
Досвід 3. Відмінність подвійних солей від комплексних сполук
Налити в три пробірки по 5 крапель розчину залізо-амонійних квасцов NH4 Fe (SO4) 2. В одну з них додати кілька крапель роданида амонію NH4 NCS; в іншу долити трохи розчину BaCl2; в третю додати концентрований розчин їдкого натру NaOH і злегка підігріти. Спостерігати появу червоного забарвлення в першій пробірці, утворення білого осаду в другій і виділення аміаку з характерним запахом в третій (аміак також виявляється по зміні забарвлення вологою індикаторного папірця, піднесеної до отвору пробірки).
Написати іонні рівняння проведених реакцій. Зробити висновок, який сіллю є галун (подвійний або комплексної). Скласти рівняння електролітичноїдисоціації залізо-амонійних квасцов.
2. У пробірку з 5 краплями гексаціаноферрата (III) калію K3 [Fe (CN) 6] додати кілька крапель роданида амонію NH4 NCS. Чому не з'являється червоне забарвлення? Скласти рівняння електролітичноїдисоціації гексаціаноферрата (III) калію.
Дослід 4. Руйнування комплексного іона. Освіта нового, міцнішого комплексного іона
Для отримання розчину диамминсеребра [Ag (NH3) 2] Cl налити в пробірку з розчином NaCl (1-2 см 3) приблизно 1 см 3 розчину AgNO3. Випав осад хлориду срібла розчинити в надлишку розчину аміаку.
Отриманий розчин солі [Ag (NH3) 2] Clразліть в дві пробірки. В одну з них додати розчин азотної кіслоти.Об'ясніть утворення осаду, написати молекулярні та іонні рівняння реакцій утворення та руйнування комплексного іона.
В іншу пробірку додати розчин NiSO4. знову випадає білий осад AgCl. Скласти в молекулярної та іонної формі рівняння реакції, маючи на увазі, що крім осаду хлориду срібла утворюється сульфат гексаамміннікеля (II).