Активний центр ферментів, що володіють абсолютною субстратной специфічністю, комплементарен тільки одному субстрату. Слід зазначити, що таких ферментів в живих організмах мало.
Приклад ферменту з абсолютною субстратной специфічністю - аргіназа, що каталізує реакцію розщеплення аргініну до сечовини і орнітину: Інший приклад ферменту з абсолютною субстратной специфічністю - уреаза, що каталізує гідроліз сечовини до діоксиду вуглецю та аміаку.
Групова Субстратна специфічність
Більшість ферментів каталізує однотипні реакції з невеликою кількістю (групою) структурно схожих субстратів. Так, фермент панкреатическая ліпаза каталізує гідроліз жирів у дванадцятипалій кишці людини, каталізує перетворення будь-якої молекули жиру (триацилгліцеролів) до молекули моноацілгліцерола і двох молекул вищих жирних кислот. Панкреатическая ліпаза гідролізує ефірну зв'язок у # 945; -атомов вуглецю гліцерину, незалежно від того, які жирні кислоти входять до складу молекули жиру
Більшість протеолітичних ферментів, які здійснюють гідроліз білків, має групову субстратне специфічність, гидролизуя пептидні зв'язки, утворені різними амінокислотами.
При наявності у субстрату декількох стерео-ізомерів фермент проявляє абсолютну специфічність до одного з них. В організмі людини спостерігають специфічність ферментів до наступних стереоізомерів.
· Стереоспеціфічность до D-цукрів. Більшість моносахаридів і продуктів їх обміну в організмі людини та інших ссавців відносять до D-стереоізомерів. Ферменти, які здійснюють їх метаболізм, мають специфічність до D-, а не до L-сахарам.
· Стереоспеціфічность до L-амінокислот. Білки людини складаються з амінокислот L-ряду. Більшість ферментів, що забезпечують перетворення амінокислот, має стереоспеціфічность до L-амінокислот.
· Стереоспеціфічность до цістрансізомерам. Фермент фумарази надає дію тільки на фумарат. Малеінат (цис-ізомер фумарата) не є субстратом фумарази.
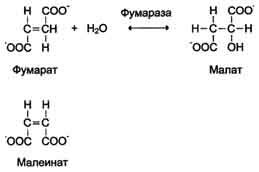
· Виключення становлять тільки ферменти епімерази (рацемази), що каталізують перетворення оптичних ізомерів.
· Стереоспеціфічносгь до # 945; - і # 946; -глікозидними зв'язків. Фермент амілаза діє тільки на а-Глікозидний зв'язку, що дозволяє гідролізотать крохмаль і глікоген (полімери глюкози), залишки глюкози в яких з'єднані # 945; -глікозидними зв'язками. Целюлоза - також полімер глюкози, проте залишки глюкози в ньому пов'язані # 946; -глікозидними зв'язками. В результаті відсутності у людини ферментів, специфічних до # 946; -глікозидними зв'язку, целюлоза НЕ гідролізують в кишечнику людини і не може служити джерелом глюкози.
· Етапи ферментативного каталізу
· 1. Формування фермент-субстратного
комплексу
· Той факт, що ферменти мають високу специфічність, дозволив в 1890 р висунути гіпотезу, згідно з якою активний центр комплементарен субстрату, тобто відповідає йому як "ключ замку". Після взаємодії субстрату ( "ключ") з активним центром ( "замок") відбуваються хімічні перетворення субстрату в продукт. Активний центр при цьому розглядався як стабільна, жорстко детермінована структура.
· У 1959 р був запропонований інший варіант гіпотези "ключ-замок", яка пояснювала б події в активному центрі ферменту. За цією гіпотезою активний центр є гнучкою структурою
·
· По відношенню до субстрату. Субстрат, взаємодіючи з активним центром ферменту, викликає зміна його конформації, приводячи до формування фермент-субстратного комплексу, сприятливого для хімічних модифікацій субстрату. При цьому молекула субстрату також змінює свою конформацію, що забезпечує більш високу ефективність ферментативної реакції. Ця "гіпотеза індукованої відповідності" згодом отримала експериментальне підтвердження.
· 2. Послідовність подій в ході
ферментативного каталізу
· Процес ферментативного каталізу умовно можна розділити на наступні етапи
· Перший, другий і четвертий етапи каталізу нетривалі і залежать від концентрації субстрату (для першого етапу) і констант зв'язування лігандів в активному центрі ферменту (для першого і третього етапів). Зміни енергетики хімічної реакції на цих стадіях незначні.
· Третій етап найбільш повільний; тривалість його залежить від енергії активації хімічної реакції. На цій стадії відбуваються розрив зв'язків в молекулі субстрату, утворення нових зв'язків і формування молекули продукту.
· 3. Роль активного центру в ферментативном
каталізі
· В результаті досліджень було показано, що молекула ферменту, як правило, у багато разів більше молекули субстрату, що піддається хімічному перетворенню цим ферментом. У контакт з субстратом вступає лише невелика частина молекули ферменту, зазвичай від 5 до 10 амінокислотних залишків, які формують активний центр. Роль інших амінокислотних залишків полягає в забезпеченні правильної конформації молекули ферменту для оптимального протікання хімічної реакції.
· Активний центр на всіх етапах ферментативного каталізу можна розглядати як пасивний ділянку для зв'язування субстрату. Це комплексна молекулярна "машина", що використовує різноманітні хімічні механізми, що сприяють перетворенню субстрату в продукт.
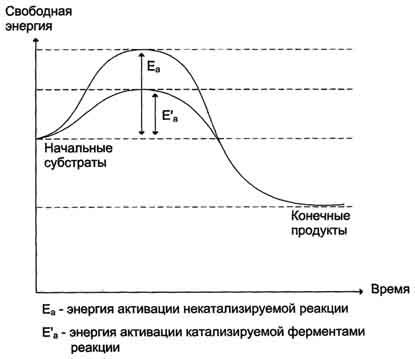
· В активному центрі ферменту субстрати розташовуються таким чином, щоб беруть участь в реакції функціональні групи субстратів знаходилися в безпосередній близькості один до одного. Ця властивість активної центру називають ефектом зближення і орієнтації реагентів. Таке впорядковане розташування субстратів викликає зменшення ентропії і, як наслідок, зниження енергії активації (Еа), що визначає каталітичну ефективність ферментів.
· Активний центр ферменту також сприяє дестабілізації міжатомних зв'язків в молекулі субстрату, що полегшує перебіг хімічної реакції і утворення продуктів. Ця властивість активної центру називають ефектом деформації субстрату.
23.понятіе холоферменту, апофермент, кофактор, субстрат, продукт реакції, інгібітор, актіватор.прімери.
1.Простетіческіе групи міцно пов'язані з білками і навіть можуть бути приєднані ковалентними зв'язками. Часто грають важливу роль у функціонуванні ферментів. Білок без простетичної групи називається «апобелок», а білок з приєднаною групою - «холобелок» (або, відповідно, в разі ферментів - апофермент і холоферменту).
Прикладом може бути гем, який є простетичної групою в молекулі гемоглобіну.
2.Кофактор-небілкова речовина, яке обов'язково має бути присутнім в організмі в невеликих кількостях, щоб відповідні ферменти змогли виконати свої функції. До складу кофактора входять коферменти і іони металів (наприклад, іони натрію і калію).
3.субстрат-речовина, що піддається перетворенню під дією ферменту;
4. Ферментативний інгібітор - речовина, що сповільнює протікання ферментативної реакції. Розрізняють оборотні і необоротні інгібітори.Ізученіе інгібування ферментів грає важливу роль в створенні ліків, у вивченні механізму дії і структури ферментів.