# 132; Це не було явищем звичайним світіння моря. Чудовисько, виринувши в поверхневі водні шари, відпочивало в декількох під туазов рівнем океану, і від нього цей виходив яскравий, сили незрозумілою світло, про який згадували в своїх багато донесеннях капітани # 133 ;.
- Так це скупчення просто фосфоресцирующих організмів! - один вигукнув з офіцерів.
- Ви помиляєтеся, пане, - заперечив я рішуче. - Ніколи фолади або сальпи не виділяють світиться настільки речовина. Це електричного світло походження # 133; # 147;
Мал. 1. Отримання електроенергії на тепловій електростанції
Хто з читачів в дитинстві не занурювався в глибини океану на # 132; Наутілусі # 147 ;? Електрика для свого капітан корабля Немо отримував шляхом перетворення прямого хімічної енергії в електрику в натрій-амальгамной батареї. Зараз частина велику електрики виробляють, хімічну перетворюючи енергію за допомогою окисно-відновних реакцій. Окислювачем кисень служить повітря, а відновником (паливом) - вугілля, природний газ, нафту і т. Д. Різниця вихідних енергій речовин і продуктів переходить в тепло, потім в механічний рух, а воно - в електрику. Для здійснення ланцюга цієї перетворень необхідні складні, громіздкі і дорогі механізми - котли, турбіни, генератори, і в ході перетворень цих більше вивільняється половини енергії втрачається.
Розгляд окислювально-відновної реакції (першої ланки в ланцюзі перетворень) наводить на думку: чи не можна електрон спокусити перейти з молекули окислювача на молекулу палива по дроту і так перетворити безпосередньо енергію реакції в електрику? Вперше прийшло це в голову судді англійської та вченому-любителю серу Вільяму Грові 165 років тому. Його апарат собою представляв електрохімічний осередок, на аноді окислюється якої водень, на катоді відновлювався кисень, і по дроту, анод з'єднував з катодом, йшов струм. Сер Грові свій назвав апарат # 132; газовій батареєю # 147 ;, а ім'я # 132; паливний елемент # 147; апарат цей отримав років п'ятдесят тому, з легкої руки Людвіга Монд (теж хіміка-аматора, по основній же професії - бізнесмена, одного із засновників величезної # 132; Imperial Chemical Industries # 147;).
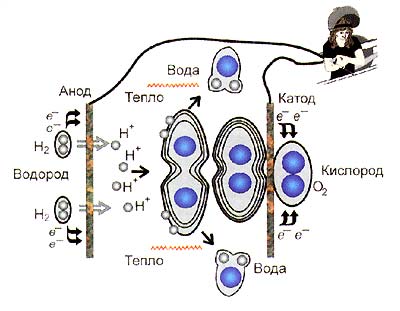
Мал. 2. Пряме хімічної перетворення енергії в енергію поля електричного в ході окислювально-відновної реакції
При роботі елемент паливний майже не нагрівається - вивільняється в ході енергія реакції переходить безпосередньо в електрику. Оскільки в паливному немає елементі проміжного хімічної пребразованія енергії в тепло, його ккд не обмежений правилом Карно і, в залежності від конкретної реакції, можливо і 100%, і навіть більше! зрозуміло, # 132; виробництва енергії з нічого # 147; не відбувається, але в деяких випадках за рахунок зміни в ході реакції не тільки енергетичних, але і ентропійних реагентів параметрів в енергію поля електричного переходить і частина енергії теплової навколишнього середовища. Сьогодні апарат Грові - тонка це (1-3 мм) прямокутна коробочка, містить яка два електроди і концентровану луг - електроліт.
Анод і катод - бічні це стінки, і до них відповідно подаються кисень і водень. Електроди контакт забезпечують газу і електроліту, їх пристрій показано праворуч. Перенесення відбувається заряду на кордоні трьох фаз - електрода, газу і електроліту: переходить електрон з водню на частку вугілля, а молекула розпадається водню на протони, що реагують з молекулами гідроксилу:-
2Н2 + 4ОН - → 4Н2 О + 4 е -.
-
O2 + 2Н2 О + 4 е - → 4OН -.
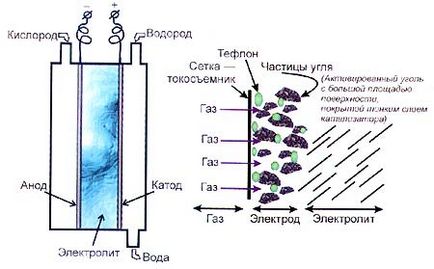
Мал. 3. Кисень-водневий елемент паливний з лужним електролітом і газодифузійний електрод для нього
Ось основна проблема: окислення реакції (згоряння) йдуть палива при кімнатній дуже температурі повільно - прореагувала щоб помітна молекул частина суміші, потрібні сотні років. Для паливного це елемента обертається низькою дуже питомою потужністю, і він повинен гігантські мати розміри.
Необхідно катодний прискорити і анодний реакції, для чого або можна використовувати каталізатор, підняти або температуру осередки. У разі кисень-водневого елемента з лужним підбір електролітом хорошого виявився каталізатора можливий; каталізатор кращий для обох електродів - платина, шаром тонким якою покривають електроди. Ці елементи паливні виявилися настільки вдалими, що їх використовували в 60-х минулого роках століття для постачання експедицій енергією на Місяць (розробником елементів паливних для місячної був експедиції сер Френсіс Т. Бекон, нащадок прямий знаменитого філософа і державного діяча Френсіса Бекона).
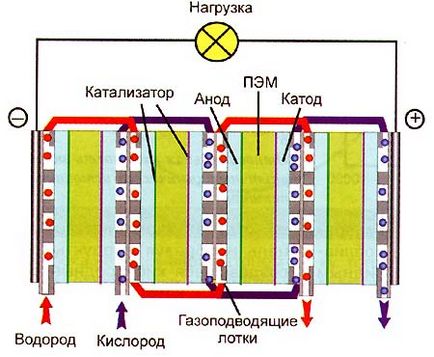
Мал. 4. Схема водень-кисневого елемента паливного з ПЕМ (батарея)
Зараз в якості # 132; електроліту # 147; використовується плівка - електролітна полімерна мембрана (ПЕМ). Вона складається з величезних полівалентної молекул кислоти, в яких збоку до вуглецевого ланцюга скелетної прикріплені кислотного групи залишку [-SO3]. а протони рухаються вільно по полімеру. Найбільш поширений ПЕМ # 151; плівка полі [тетрафторетилен] -перфторсульфоновой полікислоти, під відома торговим ім'ям # 132; Nafion # 147 ;. Сучасний елемент паливний складається з тонкої (від 50 мкм до 250 мкм) плівки # 132; Nafion # 147 ;, покритої з двох каталізатором сторін (анодним і катодним); до верствам притиснуті каталізатора пластини - струмознімачі, зроблені з якогось (тут можливі різні самі варіанти) пористого газопроникного матеріалу, який проводить добре електрику. До пластин, в свою чергу, лотки притиснуті з каналами, за якими до катода і анода кисень підводять і водень. Зазвичай в режимі максимальної віддачі потужності напруга на елементі становить 0,5-0,6 В.
Після технічного подолання бар'єру розробниками перед встав економічний: кисень-водневий виявився елемент дуже дорогий і у виробництві, і в експлуатації (для експедиції на Місяць можна цим було знехтувати). Дорожнечу елемента паливного обумовлюють платини застосування і полімерного електроліту, теж недешеве, і складність технології виробництва.

Мал. 5. Батарея 500 потужністю Вт з таких елементів
Природно два запропонувати шляхи до зниження експлуатаційних витрат: водню заміну на більш паливо звичне (метиловий спирт, паливо дизельне та т. Д.) Або зниження вимог до чистоти газу. Для вирішення останнього (що здається легшою) розробники завдання застосували в якості електроліту 100% -ву кислоту фосфорну і підняли елемента температуру до 150-200 ° С, привело що до відносного успіху - можна стало застосовувати технічний водень, що містить 1-2% чадного газу . В даний працюють час кілька осередків досвідчених такої конструкції, потужністю від 5 кВт до 200 кВт. Фосфорнокислий елемент паливний дешевше лужного, але не настільки ефективний (ккд 40-50%) і все ще доріг занадто (близько 500 дол. / КВт). Робота при високих робить температурах його непридатним для живлення переносної електроніки, а необхідність перед розігріву запуском застосування обмежує на транспорті (це відноситься і до всіх нижче названих елементів з нагріванням).
При ще високих більш температурах (800-1000 ° С) паливний працює елемент з твердим оксидним електролітом. Тут немає каталізатора, полягає елемент з тонкого суміші шару оксидів ітрію і цирконію - твердого електроліту оксидного з високою вакансій рухливістю іонів кисню; по обидві електроліту боку знаходяться сітки - струмознімачі. На стороні паливо анода реагує з іонами О 2- решітки, електрони віддаючи в зовнішній ланцюг і утворюючи продукти реакції; кисневі створені вакансії рухаються до катода по шару електроліту, а електрони - до катода по зовнішньому ланцюзі, електричний створюючи струм. На катоді приєднує кисень електрони, і утворилися іони О 2- заповнюють підійшли до катода кисневі вакансії. Такий елемент паливний володіє ккд більше 50%, не містить платини, а паливом для нього служити може не тільки водень і природний газ, але навіть дизельне паливо. Проблема в наявності високотемпературної зони, вимагає яка застосування конструкційних дорогих матеріалів і допоміжних агрегатів; служби термін цих елементів паливних поки недостатньо великий. Подібно елементам паливним з розплавленими карбонатами, елементи паливні з твердим електролітом оксидним будуть зручні найбільш для застосування у великих стаціонарних установках.
Отже, незважаючи на помітний прогрес в області елементів паливних з часу експедиції на Місяць, їх енергія залишається все ще дорогий занадто для широкого застосування - справа якщо стосується енергопостачання житла, підприємств і транспортних засобів. Ось простий приклад: найбільш вартість готового до комерційного фосфорнокислого застосування паливного елемента, з урахуванням часу амортизації, додає до вартості 1 кіловат-години близько енергії 10 рублів. Вартість водню при ккд елемента близько 50% дає енергії вартість не нижче 30 рублів за кіловат-годину, і це без обліку накладних всіляких витрат. А роздрібна ціна # 132; звичайного # 147; електрики в Америці менше 20 центів, тобто п'ять приблизно рублів за кіловат-годину.
Мал. 6. Відносна енергії щільність різних джерел хімічних харчування
Щоб паливний водневий елемент конкурентом став теплових і атомних електростанцій, енергія його повинна подешевшати не менше раз ніж о восьмій, причому подешевшати повинен як сам елемент, на що ще можна сподіватися, так і водень - для чого видимих немає підстав.
З рис. 6 видно, застосування що паливних елементів для переносної обіцяє електроніки революцію - терміну збільшення безперервної роботи автономної електронних пристроїв в 10-20 разів. Причому з усіх паливних типів елементів кандидатом відповідним виявляється елемент тільки з ПЕМ: вимагають інші для роботи температур високих і допоміжних пристроїв (наприклад. Насосів). Важко уявити собі, вдасться що розмістити в портативному джерело комп'ютері харчування з нагрітою до 200 ° С кислотою фосфорної і насос для підкачування повітря. Та й хто це захоче купити?
Мал. 7. Густині газоподібного енергій водню, рідкого водню, літій-іонної батареї і метанолу
Чому ж переносна вся електроніка ще працює на батарейках і акумуляторах, а не на паливних елементах з ПЕМ? Причина проста: - в них газоподібний використовується водень, у якого велика енергоємність на одиницю ваги, але дуже низька - на одиницю об'єму, оскільки він газ. Як видно з рис. 7. домогтися щоб такий же об'ємної щільності енергії, як у літієвої батареї, стиснути треба водень до 72 атм, а з урахуванням обсягу елемента самого і балона - до 100 атм.
Не дивно, джерела що харчування для портативної електроніки, які споживають водень, виявилися не дуже привабливі для покупців (приклад джерела такого наведено на рис. 8).
методом # 132; згущення # 147; могло б скраплення стати водню, необхідна однак для цього робить температура метод непридатним для портативних приладів. альтернатива # 132; згущення # 147; водню - іншого застосування палива. Воно мати має високу щільність енергії, бути дешевим і безпечним (екологічним. Не дуже отруйною, що не вибухонебезпечним, що не займистих при контакті з повітрям або водою і т. Д.). Оскільки паливний елемент - електрохімічна система, бажано, паливо щоб ще і добре розчинялося в воді. Краще цим все вимогам задовольняє метанол - він дешевий, змішується з водою в будь-яких пропорціях, розкладається легко в очисних спорудах і володіє в два більшої рази об'ємної щільністю енергії, навіть ніж рідкий водень.

Мал. 8. Паливний потужністю елемент 50 Вт з ПЕМ для живлення електронних портативних приладів
Видно, катодний що частина елементів обох однакова і загальна також конструкція схожа. Різниця полягає в тому, що в анодний одного відсік елемента подається водень газоподібний і відбувається реакція-
H2 → 2Н + + 2е -,
-
СН3 ОН + Н 2 О → СО2 + 6Н + + 6е -.
Мал. 9. Порівняння дії принципу метанольного і водневого елементів паливних з полімерним електролітом: рукав верхній схеми метанольний представляє ПЕМ-елемент, нижній # 132; рукав # 147; - водневий ПЕМ-елемент
Але якщо для першої підібраний реакції каталізатор (платина). дозволяє її прискорити і отримати елемент з щільністю близько потужності 0,5-0,7 Вт / см 2. то знайти каталізатор для другої реакції складніше - поки у хороших метанольного зразків ПЕМ-елемента потужності щільність 0,02-0,03 Вт / см 2. Такі величини низькі щільності призводять потужності до того, що для забезпечення енергоспоживання типового портативного приладу (10-30 Вт) паливного електрод елемента бути повинен надмірно великим. Виходить, наприклад, паливний що елемент, портативний живить комп'ютер, повинен зараз мати електроди з площею близько 500 см 2. і паливний виявиться елемент більше самого комп'ютера. Про вартість і говорити нічого - тільки один шматок плівки електроліту полімерного розміром 600 см 2 коштувати буде більше 100 дол. А покритий каталізатором - близько вже 1000 дол.
Проблема виникає каталізатора з багатостадійну електронного механізму перенесення при окисленні настільки навіть простий органічної молекули, як метанол.
З рис. 10 видно, молекула що метанолу адсорбується спочатку на електроді, потім, в ході окислення, один втрачає за іншим протони і перетворюється в міцно карбонильную адсорбовану групу, яка не бажає ні десорбувати, ні окислюватися далі.
Мал. 10. Механізм електронного постадийного перенесення в ході метанолу електроокислення на платині
В результаті через буквально дві після хвилини початку платиновий окислення електрод міцно отруєний адсорбованими групами карбонільних і більше не може окислення каталізувати метанолу.
Спроби знайти каталізатор, на активних якого центрах окислюється як метанол, так і чадний газ, начебто привели до вирішення проблеми - каталізатор з'явився з Pt / Ru-сплаву. Рутеній окисляє непогано карбонільні групи, але він - каталізатор поганий для окислення метанолу, платина ж окисляє метанол, але отруюється чадним газом. Pt / Ru-сплав - твердий розчин, якого поверхня складається з атомів платини і рутенію. Утворені на атомах карбонільні платини групи мігрують на сусідній рутенієвого атом, де і окислюються.
Але при каталізатора виготовленні на мікрорівні не відбувається перемішування ідеального атомів платини і рутенію, кожного атоми елемента тяжіють до атомам свого виду, збираються в кластери, і механізм працює міграції тільки на кордонах цих кластерів. Треба або винайти каталізатор новий для окислення метанолу, нечутливий до чадного газу, поліпшити або змішання платини атомів і рутенію в Pt / Ru-каталізаторі (недавно виповнилося 30 років з дня його винаходу). Порівняння запатентованих числа методів приготування Pt / Ru-каталізатора і патентів, присвячених катализаторам іншим для метанольного ПЕМ-паливного елемента, свідчить, ідея що удосконалення Pt / Ru-каталізатора більш популярна. Основні ідеї в цій галузі - як створення якомога менших за розміром кластерів Pt / Ru-сплаву на підкладках з вуглецевих матеріалів з величезною площею поверхні; отримані вже обнадійливі результати при використанні вуглецевих нанотрубок. Але вуглецеві поки наноматеріали дорожче платини і рутенію.
Спробуємо оцінити, возействует як поява товару нового на розвиток цивілізації. А оце все джерело стимулює харчування подальше електроніки проникнення в повсякденне життя. Можливість працювати з комп'ютером всюди, не піклуючись про наявність електричної поблизу розетки, збільшення викличе продажів комп'ютерів переносних і зменшення продажів настільних. Отримають розповсюдження широке електронні книги - спеціалізовані міні-комп'ютери, призначені для читання тексту. Це призведе до переходу частини значною видавництв на випуск книг на CD- і DVD-носіях; ринок розшириться переносних телевізорів і DVD-програвачів з плоским екраном і т. д.
Статті близької тематики:
Ривок в водневе майбутнє. Е. Глєбова.
Кроки до надлегкої енергетиці. С. М. Комаров.
Паладій. В. В. Благутіна.
Тверді полімерні електроліти. А. М. Тимонов.
Тверді оксидні електроліти. А. Дьомін.
П'ять про новел наноуглерода. М. Ю. Корнілов.
Роздуми про деякі проблеми енергетики. А. Е. Шейндлін.
Чи буде переворот в енергетиці? Г. Миколаїв.
Синтетичний лист лотоса. А. Хачоян.