В уроці 25 «Закон Бойля-Маріотта» з курсу «Хімія для чайників» розглянемо закон, що зв'язує тиск і об'єм газу, а також графіки залежності тиску від об'єму та об'єму від тиску. Нагадаю, що в минулому уроці «Тиск газу» ми розглянули пристрій і принцип дії ртутного барометра, а також дали визначення тиску і розглянули його одиниці виміру.

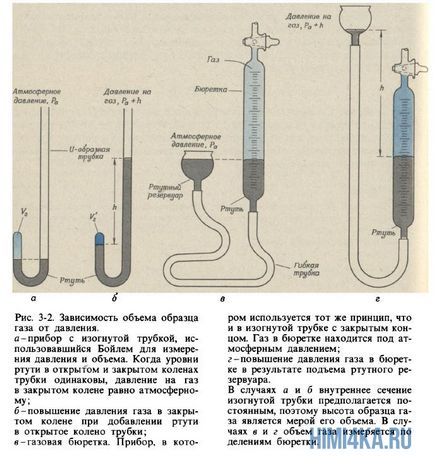
Роберт Бойль (1627-1691), якому ми зобов'язані першим практично правильним визначенням хімічного елемента (дізнаємося в гл. 6), цікавився також явищами, що відбуваються в судинах з розрідженим повітрям. Винаходячи вакуумні насоси для викачування повітря з закритих судин, він звернув увагу на властивість, знайоме кожному, кому траплялося накачувати камеру футбольного м'яча або обережно стискати повітряну кульку: чим сильніше стискають повітря в закритій посудині, тим сильніше він чинить опір стисненню. Бойль називав це властивість «пружинистістю» повітря і вимірював його за допомогою простого пристрою, показаного на рис. 3.2, а і б.

Бойль замикав ртуттю трохи повітря в закритому кінці вигнутої трубки (рис. 3-2, а) а потім стискав це повітря, потроху додаючи ртуть у відкритий кінець трубки (рис. 3-2, б). Тиск, що випробовується повітрям в закритій частині трубки, дорівнює сумі атмосферного тиску і тиску стовпчика ртуті висотою h (h - висота, на яку рівень ртуті у відкритому кінці трубки перевищує рівень ртуті в закритому кінці). Отримані Бойл дані вимірювання тиску і обсягу наведені в табл. 3-1. Хоча Бойль не робив спеціальних заходів для підтримки постійної температури газу, мабуть, в його дослідах вона змінювалася лише незначно. Проте Бойль зауважив, що тепло від полум'я свічки викликало значні зміни властивостей повітря.
Аналіз даних про тиск і обсязі повітря при його стисканні
Таблиця 3-1. яка містить експериментальні дані Бойля про взаємозв'язок тиску і обсягу для атмосферного повітря, розташована під спойлером.


Після того як дослідник отримує дані, подібні наведеним в табл. 3-1, він намагається знайти математичне рівняння. зв'язує між собою дві залежні один від одного величини, які він вимірював. Один із способів отримання такого рівняння полягає в графічному побудові залежності різних ступенів однієї величини від іншої в надії отримати прямолінійний графік. Загальне рівняння прямої лінії має вигляд:
де х і у - пов'язані між собою змінні, а a і b - постійні числа. Якщо b дорівнює нулю, пряма лінія проходить через початок координат.
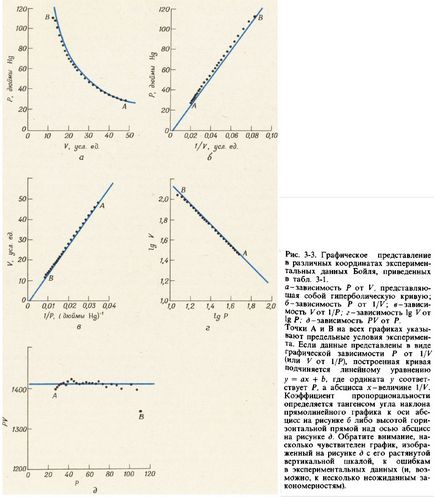
На рис. 3-3 показані різні способи графічного представлення даних для тиску Р і обсягу V, наведених в табл. 3-1. Графіки залежності Р від 1 / К і залежності V від 1 / Р є прямі лінії, що проходять через початок координат. Графік залежності логарифма Р від логарифма V також є прямою лінією з негативним нахилом, тангенс кута якого дорівнює - 1. Всі ці три графіка призводять до еквівалентним рівнянням:
Кожне з цих рівнянь являє собою один з варіантів закону Бойля-Маріотта. який зазвичай формулюється так: для заданого числа молей газу його тиск пропорційно обсягу, за умови що температура газу залишається незмінною.
До речі, напевно вам стало цікаво, чому закон Бойля-Маріотта названий подвійним ім'ям. Це сталося так, тому що цей закон незалежно від Роберта Бойля, який відкрив його в 1662 році, був перевідкритий Едмом Маріоттом в 1676 році. Ось так.
Коли взаємозв'язок між двома вимірюваними величинами проста до такої міри, як в даному випадку, її можна встановити і чисельним способом. Якщо кожне значення тиску Р помножити на відповідне значення обсягу V, неважко переконатися, що всі твори для заданого зразка газу при постійній температурі виявляються приблизно однаковими (див. Табл. 3-1). Таким чином, можна записати, що
Рівняння (З-Зг) описує гіперболічний залежність між величинами Р і V (див. Рис. 3-3, а). Для перевірки того, що побудований за експериментальними даними графік залежності Р від V дійсно відповідає гіперболі, побудуємо ще додатковий графік залежності твори P · V від Р і переконаємося, що він представляє собою горизонтальну пряму лінію (див. Рис. 3-3, д) .
Бойль встановив, що для заданої кількості будь-якого газу при постійній температурі взаємозв'язок між тиском Р і обсягом V цілком
задовільно описується співвідношенням
- P · V = const (при постійних Т і n) (3-4)
Формула з закону Бойля-Маріотта
Для зіставлення обсягів і тисків одного і того ж зразка газу при різних умовах (але постійній температурі) зручно представити закон Бойля-Маріотта в такою формулою:
де індекси 1 і 2 відповідають двом різним умовам.
Приклад 4. доставляють на плато Колорадо пластмасові мішечки з харчовими продуктами (див. Приклад 3) часто лопаються, тому що повітря, що знаходиться в них, при підйомі від рівня моря на висоту 2500 м, в умовах зниженого атмосферного тиску, розширюється. Якщо припустити, що всередині мішечка при атмосферному тиску, що відповідає рівню моря, укладено 100 см 3 повітря, який обсяг повинен займати цей повітря при тій же температурі на плато Колорадо? (Припустимо, що для доставки продуктів використовуються зморщені мішечки, що не обмежують розширення повітря; відсутні дані слід взяти з прикладу 3.)
Рішення
Скористаємося законом Бойля в формі рівняння (3-5), де індекс 1 будемо відносити до умов на рівні моря, а індекс 2 - до умов на висоті 2500 м над рівнем моря. Тоді Р1 = 1,000 атм, V1 = 100 см 3. Р2 = 0,750 атм, а V2 слід обчислити. Отже,