При зануренні металу не в воду, а в розчин солі цього металу рівновагу відповідно до принципу Ле Шательє зміщується вліво і тим більше, чим вище концентрація іонів металу в розчині. Активні метали, іони яких мають гарну здатність переходити в розчин, будуть в цьому випадку заряджатися негативно, хоча в меншій мірі, ніж в чистій воді.
Рівновага можна змістити вправо, якщо той чи інший спосіб видаляти електрони з металу. Це призведе до розчинення металевої пластинки. Навпаки, якщо до металевої платівці підводити електрони ззовні, то на ній буде відбуватися осадження іонів з розчину.
При зануренні металу в розчин на кордоні розділу фаз утворюється подвійний електричний шар. Різниця потенціалів, що виникає між металом і навколишнього його рідкою фазою, називають електродним потенціалом. Цей потенціал є характеристикою окислювально-відновної здатності металу у вигляді твердої фази.
У ізольованого металевого атома (стан одноатомного пара, що виникає при високих температурах і високих ступенях розрідження) окислювально-відновні властивості характеризуються іншою величиною, званої іонізаційним потенціалом. Іонізаційний потенціал - це енергія, необхідна для відриву електрона від ізольованого атома.
Абсолютне значення електродного потенціалу не можна виміряти безпосередньо. Разом з тим не становить труднощів вимір різниці електродних потенціалів, яка виникає в системі, що складається з двох пар метал - розчин. Такі пари називають напівелементах. Домовилися визначати електродні потенціали металів по відношенню до так званого стандартного водневого електроду, потенціал якого довільно прийнятий за нуль. Стандартний водневий електрод складається з спеціально приготованою платинової пластинки, зануреної в розчин кислоти з концентрацією іонів водню 1 моль / л і омивається струменем газоподібного водню під тиском 105 Па, при температурі 25 ° С.
Ряд стандартних електродних потенціалів. Якщо пластинку металу, занурену в розчин його солі з концентрацією іонів металу, що дорівнює 1 моль / л, з'єднати зі стандартним водневим електродом, то вийде гальванічний елемент. Електрорушійна сила цього елемента (ЕРС), виміряна при 25 ° С, і характеризує електродний потенціал металу, що позначається зазвичай як Е °.
Стандартні потенціали електродів, виступаючих як відновники по відношенню до водню, мають знак "-", а знак "+" мають стандартні потенціали електродів, що є окислювачами.
Метали, розташовані в порядку зростання їх стандартних електродних потенціалів, утворюють так званий електрохімічний ряд напруг металів: Li, Rb, K, Ва, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni , Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au.
Ряд напруг характеризує хімічні властивості металів:
1. Чим більше негативний електродний потенціал металу, тим більше його відновна здатність.
2. Кожен метал здатний витісняти (відновлювати) з розчинів солей ті метали, які стоять в електрохімічному ряді напруг металів після нього.
3. Всі метали, що мають негативний стандартний електродний потенціал, т. Е. Що знаходяться в електрохімічному ряді напруг металів лівіше водню, здатні витісняти його з розчинів кислот.
Як і в разі визначення значення Е ° металів, значення Е ° неметалів вимірюються при температурі 25 ° С і при концентрації всіх атомних і молекулярних частинок, що беруть участь в рівновазі, яка дорівнює 1 моль / л.
Алгебраїчне значення стандартного окисно-відновного потенціалу характеризує окислительную активність відповідної окисленої форми. Тому зіставлення значень
стандартних окисно-відновних потенціалів дозволяє відповісти на питання: чи протікає та чи інша окислювально-відновна реакція?
Кількісним критерієм оцінки можливості протікання тієї чи іншої окислювально-відновної реакції є позитивне значення різниці стандартних окисно-відновних потенціалів напівреакцій окислення і відновлення.
Водневого електроду в електрохімії - зазвичай платинована пластина, занурена в розчин кислоти з певною концентрацією іонів Н + і омивається газоподібним воднем. При тиску водню 0,1 МПa і термодинамічної активності його іонів, що дорівнює одиниці, потенціал водневого електрода умовно прийнятий рівним нулю. Такий водневий електрод називається стандартним, він служить електродом порівняння, від якого відраховують потенціали інших електродів.
32 Термодинаміка протікання електродних процесів. Мимовільність протікання окислювально-відновних реакцій. Зв'язок ЕРС гальванічного елемента з енергією Гіббса. Зв'язок ЕРС з константою рівноваги
Будь-які хімічні реакції пов'язані з переміщенням електронів, тому можуть бути використані для отримання електричного струму. При цьому джерелом електричної енергії є енергія, що звільняється при хімічної реакції. Таке перетворення енергії хімічної реакції в електричну можливо лише за допомогою спеціального пристрою, званого гальванічним елементом. Воно дозволяє направляти потік електронів по металевим провідникам.
Просте спалювання водню супроводжується великим виділенням тепла. Якщо його провести при постійному обсязі, наприклад, в калориметричних бомбі, то ДU = -284,5 кДж / моль. Якщо цю ж реакцію здійснити в гальванічному елементі електрохімічним шляхом, то частина цієї убутку внутрішньої енергії може бути використана для отримання електричного струму. Схема такого гальванічного елемента показана на рис: IX.1. У водний розчин (наприклад, NaOH) занурені два платинових електрода. Лівий електрод омивається бульбашками водню, а правий - киснем. Водень в лівій частині цього гальванічного елемента розчиняється в платині і іонізується. Внаслідок великого спорідненості до молекул води деяку кількість протонів переходить в шар розчину, безпосередньо прилягає до електрода. При цьому утворюються іони гідроксонію Н3О + - вони позначені плюсами в правій частині рис. IX. 1, а електрони (мінуси) залишаються на поверхні платинового електрода. Через електростатичного притягання між електронами і іонами гідроксонію останні залишаються поблизу електрода і не йдуть в обсяг розчину. Завдяки цьому на кордоні метал-розчин виникає так званий подвійний електричний шар, подібний двом обкладкам конденсатора. На поверхні правого електрода відбувається реакція утворення іонів гідроксилу:
3 / 2O2г + H3Oж + 2e = 2OH-
в результаті якої з металу видаляються два електрона. Поверхня металу тому заряджається позитивно і на ній також утворюється подвійний електричний шар, але протилежного знака. Якщо з'єднати лівий і правий електроди металевим провідником, то по ньому потече електричний струм. Стрілка на рис. IX.1 вказує напрямок потоку електронів. Різниця електричних потенціалів на електродах разомкнутого гальванічного елемента називається його електрорушійної силою (е. Д. С.).
Очевидно потік електронів, що виникає в елементі може бути використаний для виробництва роботи, наприклад, для обертання електричного мотора. Протікання струму призводить до зменшення зарядів подвійних електричних шарів. Тому іони Н3О + і ОН- отримують можливість віддалятися від електродів і утворювати в розчині нейтральні молекули води. Одночасно внаслідок реакцій на електродах знову відновлюються подвійні шари. Відбуваються на електродах і в розчині зміни відображаються наступними рівняннями:
3/2 O2г + H3Oж + 2e = 2OH-;
сума яких є реакцією утворення води:
H3г + 1 / 2O2г = H3Oж,
Таким чином, одну і ту ж реакцію утворення води з елементів можна здійснити двома різними способами. Який з цих способів вигідніше з точки зору перетворення енергії хімічної реакції в роботу? У першому способі при спалюванні водню в калориметричної бомби (V = const) при 298 К зменшення внутрішньої енергії дорівнює кількості виділився тепла -ДU = 284,5 кДж / моль, а робота дорівнює нулю.
У другому випадку частина цієї зміни внутрішньої енергії (ДG) може бути перетворена в електричну роботу. Якщо реакція в гальванічному елементі проводиться оборотно, то супроводжуюча її спад енергії Гіббса повністю йде на виробництво електричної роботи.
В даному випадку ДG0 = -237,2 кДж / моль і, отже, тільки ~47 кДж / моль переходить в тепло. Цей приклад показує, що взагалі енергію, що звільняється при горінні природних видів палива, вигідніше безпосередньо перетворювати в електричну, так як к. П. Д. Теплових машин і теплових електростанцій невеликий. Описаний воднево-кисневий елемент є прикладом так званих паливних елементів.
Роботи зі створення таких елементів отримали останнім часом широкий розвиток в зв'язку з новими завданнями техніки. У цих елементах паливо і окислювач повинні зберігатися окремо і подаватися до електродів, на яких здійснюються електрохімічні реакції. При цьому елемент може працювати безперервно, якщо до нього підводяться реагенти і відводяться продукти реакції, що особливо зручно при використанні рідких і газоподібних речовин. Замість спалювання вугілля можливо використовувати реакцію Ст + О2г = СО2г для отримання електричного струму.
Очевидно, що в реальних умовах гальванічні елементи працюють необоротно, тому в роботу перетворюється лише частина зміни енергії Гіббса реакції, що протікає в елементі. Повторимо, що гальванічний елемент може працювати за умови протікання в ньому мимовільної хімічної реакції або будь-якого іншого самовільного процесу, що супроводжується спадом енергії Гіббса.
Якщо до даної гальванічного елемента докласти ззовні досить велику різницю потенціалів, що перевищує його е. д. з. і має протилежний зміст, то буде відбуватися розкладання води з виділенням водню і кисню. Таким чином, процеси отримання електричного струму в гальванічних елементах і електролізу взаємно протилежні.
Особливістю електрохімічного процесу в гальванічному елементі є важлива для теорії можливість його здійснення в умовах досить близьких до оборотності. Це досягається завдяки потенциометрическом методу, в якому е. д. з. досліджуваного гальванічного елемента практично повністю компенсується за допомогою протилежно спрямованої Е.Д. с. зовнішнього джерела. Такий прийом дозволяє вимірювати ЕРС при відсутності струму в ланцюзі, тобто коли елемент не працює, а його е.р.с. максимальна. Контроль за відсутністю струму проводять гальванометра (нуль-інструментами) високої чутливості. Вони дають відхилення при проходженні струму силою 10-8 - 10-9 А. Такий слабкий струм при проходженні через електроліт навіть протягом багатьох років не зміг би виділити скільки-небудь помітних кількостей речовини.
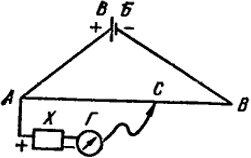
Мал. IX.2. Схема вимірювання е.р.с. методом компенсації.
Принципова схема вимірювання е. д. з. гальванічного елемента компенсаційним методом показана на рис. IX.2. Постійний струм від допоміжної батареї СБ подається на кінці реохорда АВ - дроту з постійним перетином. Тому падіння напруги вздовж реохорда пропорційно довжині відповідного відрізка на прямій АВ. За допомогою рухомого контакту С можна відбирати довільну частину падіння напруги між точками А і В. З рис. IX.2 видно, що напруга, що знімається з будь-якої ділянки реохорда, наприклад АС, направлено назустріч е. д. з. елемента X.
Пересуваючи контакт З по реохорд, знаходять таке положення, при якому нуль-гальванометр Г вказує відсутність струму в ланцюзі АХГС. Це означає, що падіння потенціалу від СБ на відрізку АС повністю компенсує е. д. з. елемента X.