ЕЛЕКТРИЧНОГО ЗАРЯДУ МЕТОДОМ ЕЛЕКТРОЛІЗУ
Обладнання: джерело постійного струму, кювета з електродами з набору «Електроліт», вольтметр лабораторний, резистор, ваги з гирями або електронні, ключ, з'єднувальні дроти, розчин мідного ку-поросят, секундомір (або годинник із секундною стрілкою).
ПОЯСНЕННЯ ДО РОБОТИ. Для визначення заряду електрона можна скористатися законом електролізу Фарадея, де т - маса речовини, яка виділяється на катоді; М - молярна маса речовини; п - валентність речовини; е - заряд електрона; Na - постійна Авогадро; I - сила струму в електроліті; # 8710; t - час проходження струму через електроліт.
З цієї формули видно, що для досягнення мети роботи необхід-мо знати молярну масу речовини, яка виділяється на катоді, його ва-лентность і постійну Авогадро. Крім того, в ході досвіду потрібно через міряти силу струму і час його протікання, а після закінчення електролізу - масу речовини, яка виділяється на катоді.
Для проведення досліду використовується насичений водний розчин мідного купоросу, який наливають в кювету з двома мідними еле-ктродамі. Один електрод жорстко закріплений в центрі кювети, а інший (знімний) - на її стінці.
У водному розчині відбувається дисоціація молекул не тільки мідного купоросу (CuS04 = Cu2 + +), але і води (Н20 = Н + + ОН -), хоча і в слабкому ступені. Таким чином, у водному розчині CuS04 містяться як позитивні іони Си2 + і Н +, так і негативні іони SO2- і ОН-. Якщо між електродами створити електричне поле, то позитивні іони почнуть рухатися до катода, а отрицатель-ні - до анода. До катода підходять іони Си2 + і Н +, але розряджаються не всі з них. Це пояснюється тим, що атоми міді і водню легко переходять в позитивно заряджені іони, втрачаючи свої зовнішні електрони. Але іон міді легше приєднує електрон, ніж іон водо-роду. Тому на катоді розряджаються іони міді.
До анода будуть рухатися негативні іони і ОН-, але жоден з них розряджатися не буде. При цьому мідь почне розчиняти-ся. Це пояснюється тим, що атоми міді легше віддають електрони в зовнішній ділянку електричного кола, ніж іони і ОН - і, ставши позитивними іонами, будуть переходити в розчин: Cu = Cu2 + + 2e-.
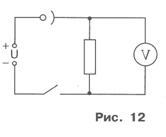
Таким чином, при підключенні електродів до джерела постійного-ного струму в розчині мідного купоросу виникне спрямоване дви-ються іонів, наслідком якого буде виділення на катоді чистої міді.
Для того щоб шар виділилася міді був щільним і добре утримувався на катоді, електроліз рекомендується проводити прі не-великій силі струму в розчині. А так як це призведе до великої по-похибки вимірювання, то замість лабораторного амперметра в роботі використовують резистор і вольтметр. За свідченням вольтметра U і со-супротиву резистора R (воно зазначено на його корпусі) визначають сі-лу струму I / Принципова схема експериментальної установки показана на малюнку 12.
Сила струму в електроліті в ході досвіду може змінюватися, тому в формулу для визначення заряду під-ють її середнє значення 1ср. Середнє значення сили струму визначають, записуючи через кожні 30 з показання вольтметра на протяже-ванні всього часу спостереження, потім їх сум-міруют і отримане значення ділять на число вимірів. Так знаходять Ucp. Потім по закону Ома для ділянки ланцюга знаходять Icp. Запи-сі результатів вимірювань напруги зручніше заносити у допо-тільну таблицю.
Час протікання струму вимірюють секундоміром.
ПОРЯДОК ПІДГОТОВКИ ДО РОБОТИ
1. Вкажіть, які фізичні величини підлягають прямому вимірюванню для визначення заряду електрона методом, використовуваним в даній роботі. За допомогою яких вимірювальних приладів будуть проведені виміри? Визначте і запишіть кордону абсолютних похибкою-тей цих приладів.
2. Визначте і запишіть кордону абсолютних похибок отсч-ту при використанні механічного секундоміра, вольтметра і ваг.
3. Запишіть формулу для визначення межі абсолютної похибкою-ності # 8710; е.
4. Підготуйте таблицю для запису результатів вимірювань, похибок і обчислюва-лений.
Підготуйте допоміжну таблицю для запису свідчень вольт-метра.
ДАЙТЕ ВІДПОВІДЬ НА ПИТАННЯ
Чому час протікання струму в електроліті впливає на похибкою-ність результату вимірювання заряду електрона?
Як концентрація розчину впливає на результат вимірювання за-ряду електрона?
Чому дорівнює валентність міді?
Чому дорівнює молярна маса міді?
Чому дорівнює постійна Авогадро?
ПОРЯДОК ВИКОНАННЯ РОБОТИ
1. Визначте на вагах масу знімного електрода т1.
2. Закріпіть електрод на кюветі і зберіть електричний ланцюг, по-здаватися на малюнку 12. Простежте, щоб знімний електрод надав-ся підключеним до негативного полюса джерела напруги.
3. Заповніть кювету розчином мідного купоросу, замкніть ключ і через кожні 30 с на протязі 15 хв записуйте показання вольт-метра.
4. Через 15 хв розімкніть ключ, розберіть ланцюг, зніміть електрод, висушіть і визначте його масу т2 разом з осілої на ньому міддю.
5. Обчисліть масу виділилася міді: т- і кордон аб-солютной похибки її вимірювання # 8710; т.
6. Обчисліть середнє значення напруги на резисторі Uср і середнє значення сили струму в електроліті I пор.
7. Обчисліть заряд електрона е.
8. Обчисліть кордон абсолютної похибки визначення заряду електрона # 8710; е.
9. Запишіть результат визначення заряду з урахуванням межі абсолютної похибки.
10. Порівняйте заряд електрона, визначений за результатами проведено-ного досвіду, з табличним значенням.