Загальні відомості про валентності сірки
Сірка розташована в третьому періоді VI групі головною (А) підгрупі Періодичної таблиці.
При звичайному тиску сірка утворює тендітні кристали жовтого кольору, що плавляться при температурі 112,8 o С. Щільність 2,07 г / см 3. нерозчинні в воді, але досить добре розчинна в сероуглероде, бензолі і деяких інших рідинах. При випаровуванні цих рідин сірка виділяється з розчину у вигляді прозорих жовтих кристалів ромбічної системи, що мають форму октаедрів (ромбічна модифікація).
Якщо розплавлену сірку повільно охолоджувати і в той момент, коли вона частково твердне злити ще не встигла застигнути рідину можна отримати довгі темно-жовті голчасті кристали моноклінної системи (моноклінна модифікація). Щільність 1,96 г / см 3. Температура плавлення 119,3 o С.
Валентність сірки в з'єднаннях
Сірка - шістнадцятий за рахунком елемент Періодичної таблиці Д.І. Менделєєва. Вона знаходиться в третьому періоді в VIA групі. В ядрі атома сірки міститься 16 протонів і 16 нейтронів (масове число дорівнює 32). В атомі сірки є три енергетичних рівня, на яких знаходяться 16 електронів (рис. 1).
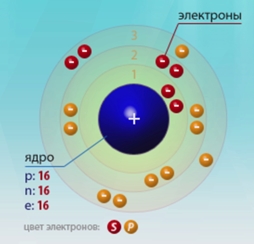
Мал. 1. Будівлі атома сірки.
Електронна формула атома сірки в основному стані має наступний вигляд:
А енергетична діаграма (будується тільки для електронів зовнішнього енергетичного рівня, які по-іншому називають валентними):
Наявність двох неспарених електронів свідчить про те, що сірка здатна виявляти валентність II в своїх з'єднаннях (H2 S II).
Для атома сірки характерна наявність декількох збуджених станів через те, що орбіталі 3d -подуровня є вакантними (на третьому енергетичному шарі крім 3s- і 3p-підрівнів є ще і 3d-підрівень). Спочатку розпарюються електрони 3p -подуровня і займають вільні d орбіталі, а після - електрони 3s -подуровня:
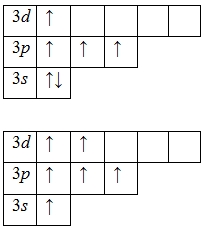
Наявність чотирьох і шести неспарених електронів в збудженому стані свідчить про те, що сірка виявляє в своїх з'єднаннях валентності IV (S IV O2. H2 S IV O3. Na2 S IV O3) та VI (S VI O3. H2 S VI O4. CaS VI O4).