Загальні відомості про валентності кобальту
Кобальт - елемент четвертого періоду VIII групи побічної (B) підгрупи Періодичної таблиці. Метал. Позначення - Co. Порядковий номер - 27.
У вигляді простого речовини кобальт - блискучий білий метал з жовтуватим відтінком. У порівнянні з залізом кобальт більш твердий і крихкий. Щільність 8,90г / см 3. Температура плавлення тисячі чотиреста дев'яносто дві o С, кипіння 2960 o С.
Кобальт має дві модифікації. До 430 o С стійкий α-кобальт з гексагональної плотноупакованной гратами, вище 430 o С - β-кобальт з гранецентрированной кубічної гратами.
Валентність кобальту в сполуках
Кобальт - двадцять сьомий за рахунком елемент Періодичної таблиці Д.І. Менделєєва. Він знаходиться в четвертому періоді в VIIIв групі. В ядрі атома кобальту міститься 27 протонів і 32 нейтрон f (масове число дорівнює 59). В атомі кобальту є чотири енергетичних рівня, на яких знаходяться 27 електронів (рис. 1).
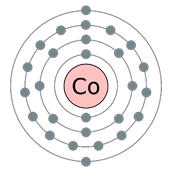
Мал. 1. Будова атома кобальту.
Електронна формула атома кобальту в основному стані має наступний вигляд:
А енергетична діаграма (будується тільки для електронів зовнішнього енергетичного рівня, які по-іншому називають валентними):
Наявність трьох неспарених електронів свідчить про те, що кобальт проявляє в своїх з'єднаннях валентність III (Co2 O3. Co (OH) 3. CoCl3. Co2 S3). Відомо, що для кобальту також характерна валентність II (CoO, Co (OH) 2. CoCl2. CoBr2).
Приклади розв'язання задач
Кобальт масою 2,95 г розчинили в соляній кислоті, при цьому утворилася сіль кобальту (II), через отриманий розчин пропустили сірководень. Визначте масу утвореного осаду.
Запишемо рівняння реакцій, про які йдеться в умові завдання:
Знайдемо кількість речовини кобальту, що вступив у реакцію (молярна маса - 59 г / моль):
n (Co) = m (Co) / M (Co);
n (Co) = 2,95 / 59 = 0,044 моль.
Відповідно до рівняння (1) n (Co). n (CoCl2) = 1: 1, отже, n (Co) = n (CoCl2) = 0,044 моль. Тоді, кількість моль сульфіду кобальту (II) (осад) також дорівнюватиме 0,044 моль, оскільки n (CoCl2). n (CoS) = 1: 1. Маса сульфіду кобальту (II) дорівнює (молярна маса - 91 г / моль):
m (CoS) = n (CoS) × M (CoS);
m (CoS) = 0,044 × 91 = 4,004 м
Маса сульфіду кобальту (II) дорівнює 4,004 м
Стандартний електродний потенціал нікелю більше, ніж кобальту (E o Co 2+ / Co o = -0,27 В, E o Ni 2+ / Ni 0 = -0,25 В). Чи зміниться це співвідношення, якщо виміряти потенціал нікелю в розчині його іонів з концентрацією 0,001 моль / дм 3. а потенціал кобальту - в розчині з концентрацією 0,1 моль / дм 3.
Визначимо електродні потенціали кобальту і нікелю в заданих умовах використовуючи рівняння Нернста:
E 'Ni 2+ / Ni 0 = -0,25 + (0,059 / 2) × lg10 -3;
E 'Co 2+ / Co o = -0,27 + (0,059 / 2) × lg10 -1;