
Головна | Про нас | Зворотній зв'язок
У твердих тілах атоми розташовуються у відносному порядку (кожен щодо інших), що забезпечується наявністю постійних зв'язків між ними. Квантовомеханічний рівняння Шредінгера, що описує характер руху електронів в атомі, дає можливість пояснити і природу зв'язків, що виникають між атомами при утворенні кристалічної структури твердих тіл. При достатньому зближенні атомів (молекул) між ними виникає взаємодія, що приводить до появи сил прітяж-ня і відштовхування.
Найбільш загальним видом зв'язку, що виникають між будь-якими ато-мами і молекулами, є сили Ван-дер-Ваальса. Вперше ці сили були введені для пояснення відступу реальних газів від рівняння стану ідеальних газів. Звідси походить і їх назва. У рівнянні Ван-дер-Ваальса
ці сили визначають поправку (a / V 2). Поправка b враховує дію сил відштовхування.
Чудовим властивістю сил Ван-дер-Ваальса є те, що вони виникають між електрично нейтральними системами і системами, що не володіють електричним моментом. При взаємодії-дії інертних газів вони є єдиними силами, де-гавкаючим можливим існування рідкого і твердого стану цих речовин.
Атоми, що стоять в періодичній системі Менделєєва поруч з інертними газами, має схильність приймати їх конфігу-рацію шляхом віддачі або прийняття електронів. У атомів лужних металів, що стоять безпосередньо за інертними газами, валент-ний електрон рухається поза заповненого шару і пов'язаний з ядром слабо. У галоідов, що стоять безпосередньо перед інертними га-зами, бракує одного електрона для заповнення стійкого шару благородного газу. Тому вони мають високу спорідненість до додаткового електрону.
Зв'язок між такого роду атомами, т. Е. Між типовими ме-Таллі і галоидами здійснюється наступним чином. Вна-чале відбувається іонізація обох атомів: електрон від атома металу переходить до атома галоида. При цьому атом металу прев-ращается в позитивно заряджений іон, атом галоида - в від-ріцательно зарядженийіон. Ці іони взаємодіють між собою за законом Кулона, як два різнойменних заряду. Такий зв'язок отримала назву іонної або полярної.
Наявністю двох типів зв'язків (полярної і Ван-дер-ваальсово зв'язку) неможливо пояснити існування великого твердих тіл. Зокрема, однорідні атоми не можуть утворити, очевидно, протилежно заряджених іонів шляхом перерозподілу валентних електронів, як це має місце при взаємодії металів з галоидами. Насправді для твердих тіл, що складаються з однакових атомів, реалізується ковалентний тип зв'язків. Такий тип зв'язків називають також гомеополярной і обмінної.
Ковалентний зв'язок виникає при зближенні атомів однієї і тієї ж природи (наприклад атома А і атома В). Розглянемо у кожного з цих атомів два валентних електрона (1 і 2). Ядра цих атомів позначимо як а і b. Внаслідок того що щільність електронної хмари, що описує стан електрона в атомі, дуже швидко падає з відстанню, виявити електрон 1 у ядра b, а електрон 2у ядра а дуже малоймовірно. Розрахунок показує, що при r = 50 А кожен з електронів може побувати у «чужого» ядра один раз в середньому за 10 12 років. Тому атоми А і В можна розглядати як ізольовані і енергію системи, що складається з таких атомів, повинна дорівнювати 2Е0, де Е0 - енергія ізольованого атома в нормальному стані.
У міру зближення атомів ймовірність переходу електронів до «чужим» ядер збільшується. При деякому досить малій відстані між ядрами атомів настає помітне перекриття електронних хмар цих атомів, а частота перехо-да збільшується вже приблизно до 10 14 сік -1. При подальшому зближенні ступінь перекриття хмар зростає і частота обміну електронів місцями збільшується настільки, що втрачає сенс говорити про приналежність електрона 1 до атому А. а електрона 2к атому В. Це відповідає виникненню нового стану, не властивого системі, що складається з двох ізольованих атомів, і чудового тим, що електрони в цьому стані належать одночасно обом ядрам, або, як кажуть, усуспільнено.
Існує ще один вид зв'язків між однаковими атомами - металева зв'язок. Такий зв'язок характерна для металів: в вузлах решітки металів знаходяться позитивно заряджені іони, хі-мическая зв'язок між якими здійснюється за допомогою сво-Бодня електронів, що утворюють електронний газ. Металева зв'язок виникає в тому випадку, коли невелика кількість валентних електронів, а при цьому вони слабкіше пов'язані з ядрами. При обра-зовании металів електронні оболонки валентних електронів перекриваються, тому валентні електрони отримують можли-ність переходити від одного атома до іншого і вільно перемі-тися по всьому кристалу. Вільні електрони пов'язують по-ложітельние іони в міцну структуру. Металева зв'язок більш гнучка і пластична, ніж іонна. В металах відбувається усуспільнення електронів; ці електрони весь час знаходяться між атомами. У разі металевої зв'язку в усуспільнення валентних електронів беруть участь всі атоми кристала і усуспільнені електрони не локалізуються вже у своїх атомів, а вільно пе-ремещаться всередині всієї решітки.
Слід зазначити, що найбільш універсальною зв'язком є зв'язок Ван-дер-Ва-Альс. Вона виникає у всіх без винятку випадках. Разом з цим це - найбільш слабка зв'язок з енергією, що не перевищує оди-ниць 8 × 10 3 дж / моль.В чистому вигляді вона проявляється при взаємодій-наслідком нейтральних атомів і молекул, що мають заповнені внут-ренніе електронні оболонки. Зокрема, сили Ван-дер-Ваальса обумовлюють існування рідкого і твердого станів інертний-них газів, водню, кисню, азоту та багатьох органічних і неорганічних сполук, забезпечують зв'язок у великій груп-пе валентно-молекулярних кристалів; це буде більш докладно викладено далі. Внаслідок того, що енергія Ван-дер-ваальсово зв'язку низька, все структури, обумовлені цим зв'язком, малоус-тойчивость, легко летких і мають низькі температури плавлення.
Іонна зв'язок є типовою хімічним зв'язком, широко поширеною серед неорганічних сполук. До них відно-сятся з'єднання металів з галоидами, оксиди металів, суль-фіди і багато інших полярні сполуки. Іонна зв'язок прису-ща також багатьом інтерметалічних сполук (карбідів, селеніди, нітриди і ін.). Енергія іонної зв'язку значно вище енергії Ван-дер-Ваальса: вона коливається приблизно від 6,7 × 10 5 дж / моль (для КСl) до 1,5-10 7 дж / моль (для оксидів алю-Мінія і хрому). Тому тверді тіла з іонним зв'язком мають високі теплоти сублімації і високі точки плавлення.
Ковалентний зв'язок має виключно широке розповсюдження-ня в органічних сполуках, але зустрічається також в не-органічних сполуках, в деяких металах і під мно-гих интерметаллических з'єднаннях. Цей зв'язок обумовлює об-разование валентних кристалів типу алмазу, германію та т. П. Енергія валентного зв'язку висока: одинарна зв'язок «вуглець - вуглець» (С - С) в органі-чеських з'єднаннях має енергію порядку 3-10 5 дж / моль. таку ж величину має цей зв'язок і в решітці алмазу, про що сві-чать висока температура плавлення і велика теплота сублімації.
Нарешті, металева зв'язок, що виникає в результаті усуспільнення валентних електронів, характерна для типових металів і багатьох інтер металевих з'єднань. Енергія зв'язку з цим по порядку величини можна порівняти з енергією валентного зв'язку.
Слід підкреслити, що в реальних твердих тілах кожна з розглянутих зв'язків в чистому вигляді майже ніколи не зустрічається. Практично завжди має місце накладення двох і більше типів зв'язків. Одна з них має, як правило, превалирую-ний значення, визначаючи структуру і властивості тіла.
Для опису правильної внутрішньої структури твердих тіл користуються поняттям просторової або кристали-чеський решітки.
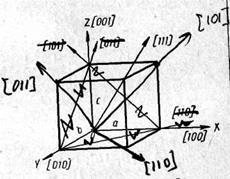
З даних цієї таблиці видно, що в залежності від напрямку властивості кристала можуть змінюватися дуже сильно.
На закінчення даної лекції, розглянемо відмінності в фізичні властивості монокристалічних і полікристалічних твердих тіл.
У спеціальних умовах тверде тіло може вирости у вигляді одиночного кристала - монокристалла. Однак набагато частіше в розплаві виникає одночасно велику кількість центрів кристал-зації, що дає початок росту великого числа окремих кристал-ликів. Розростаючись, вони поступово зближуються один з одним, зростаються і утворюють цілісний конгломерат - полікристал. Зрощені кристалітів (зерна) мають зазвичай форму неправильних багатогранників, зовнішня огранювання яких абсолютно не відображає їх правильного внутрішньої будови. Так як розподіл і орієнтація центрів кристалізації в охолоджуваному розплаві вдосконалення-шенно випадкові, то і орієнтація зрощених зерен друг щодо відповідності-но одного виявляється також випадковою. Тому полікристал не проявляє помітної залежності властивостей від напрямку - він изотропен.
Крім того, відмінність в орієнтації зростаються зерен призводить до виникнення міжкристалічних кордонів, надаю-щих сильний вплив на формування механічних властивостей по-лікрісталліческого агрегату. Навіть в гранично чистому металі, практично не містить домішок, кристалічна решітка в міжкристалічних прошарках спотворена. Спотворення не обмежиться-ється одним шаром граничних атомів, а простягається на кілька глибинних шарів, з якими граничні атоми взаємодіють. Чим більше ступінь дезорієнтації граничних зерен, тим ширше перехідна зона і тим сильніше вона спотворена.
Спотворення кристалічної решітки в міжкристалічних про-слойки є причиною локалізації в ній надлишкового коли-пра вільної енергії. Це підтверджується рядом дослідів. Так, Чалмерс встановлено, що для дуже чистого олова кордону зерен починають плавитися при кілька більш низькій температурі, ніж самі зерна. Швидкість дифузії по границях зерен більше, ніж в обсязі. Зародження нових зерен при рекристалізації починається, як правило, на кордонах старих або в місцях, де протекла найбільш інтенсивна пластична деформація, при-вела до порушення кристалічної решітки. Якщо метал з-тримає домішки, то при кристалізації ці домішки виділяються зазвичай по межах зерен, що призводить до виникнення міжкристалічних прошарків, за своїм складом і властивостями різко отли-чающіхся від самих зерен.