Гіпермаркет знань >> Хімія >> Хімія 10 клас >> Хімія: Типи реакційноздатних часток і механізми реакцій в органічній хімії.
Найбільш характерна для органічних сполук ковалентний зв'язок утворюється при перекривання атомних орбіталей і утворення загальних електронних пар. В результаті цього утворюється спільна для двох атомів орбиталь, на якій знаходиться загальна пара електронів. При розриві зв'язку доля цих загальних електронів може бути різною.
Обмінний механізм утворення ковалентного зв'язку. Гомолитически розрив зв'язку
Орбиталь з неспареним електроном, що належить одному атому, може перекриватися з орбиталью іншого атома, на якій також знаходиться неспарених електронів. При цьому відбувається утворення ковалентного зв'язку за обмінним механізмом:
Н · + · Н -> Н. Н, або Н-Н
Обмінний механізм утворення ковалентного зв'язку реалізується в тому випадку, якщо загальна електронна пара утворюється з неспарених електронів, що належать різним атомам.
Процесом, протилежним утворення ковалентного зв'язку за обмінним механізмом, є розрив зв'язку, при якому до кожного атому відходить по одному електрону. В результаті цього утворюються дві незаряджені частинки, що мають неспарені електрони:
Такі частинки називаються вільними радикалами.
Вільні радикали - атоми або групи атомів, що мають неспарені електрони.
Механізм розриву ковалентного зв'язку, при якому утворюються вільні радикали, називається гемолітичним або гомолізу (гомо - однаковий, т. Е. Такий тип розриву зв'язку призводить до утворення однакових часток).
Реакції, які протікають під дією і за участю вільних радикалів, називаються вільнорадикальних реакціями.
В курсі неорганічної хімії ви вже зустрічалися з цими процесами. Це реакції взаємодії водню з киснем, галогенами, реакції горіння. Зверніть увагу на те, що реакції цього типу відрізняються високою швидкістю, виділенням великої кількості тепла. Причини цих явищ, а також механізм самих реакцій, характерних для органічних сполук, ми розглянемо трохи пізніше.
Донорно-акцепторні механізм утворення ковалентного зв'язку. Гетеролітичною розрив зв'язку
Ковалентний зв'язок може утворитися і по донорно-акцептор-ному механізму. Одна з орбіталей атома (або аніона), на якій знаходиться неподіленого електронних пари, перекривається з незаповненою орбиталью іншого атома (або катіона), що має незаповнену орбиталь, при цьому формується ковалентний зв'язок, наприклад:
Донорно-акцепторні механізм утворення ковалентного зв'язку реалізується в тому випадку, якщо загальна електронна пара утворюється з неподіленої електронної пари одного атома - донора. Другий атом, акцептор, повинен надати незаповнену орбиталь.
Спосіб розриву ковалентного зв'язку, зворотний її утворення по донорно-акцепторного механізму, - гетеролітичною, або ге-теролиза, призводить до утворення позитивно і негативно заряджених частинок, так як в даному випадку обидва електрона із загальної електронної пари залишаються при одному з атомів, в іншого атома виходить незаповнена орбиталь:
Уже відомим нам з курсу неорганічної хімії випадком гетеролиза є електролітична дисоціація кислот:
Можна легко здогадатися, що частка, що має неподеленную електронну пару R: -. т. е. негативно заряджений іон, буде притягатися до позитивно заряджених атомів або до атомам, на яких існує принаймні частковий або ефективний позитивний заряд. Частинки з неподіленими електронними парами називають нуклеофіл'нимі агентами (nucleus - ядро, позитивно заряджена частина атома), т. Е. «Друзями» ядра, позитивного заряду.
Нуклеофіли (Nu) - аніони або молекули, що мають непод-ленну пару електронів, що взаємодіють з ділянками молекул, на яких зосереджений ефективний позитивний заряд.
Приклади нуклеофілів: Сl - (хлорид-аніон), ВІН - (гідроксид-аніон), СН3O - (метоксид-аніон), СН3СОО - (ацетат-аніон).
Частинки, що мають незаповнену орбиталь, навпаки, будуть прагнути заповнити її і, отже, будуть притягатися до ділянок молекул, на яких присутня підвищена електронна щільність, негативний заряд, неподіленого електронних пари. Вони є електрофілами, «друзями» електрона, негативного заряду або частинок з підвищеною електронною щільністю.
Електрофіли - катіони або молекули, що мають незаповнену електронну орбіталь, які прагнуть до заповнення її електронами, так як це призводить до більш вигідною електронної конфігурації атома.
Не всяка частинка з незаповненою орбиталью є електрофілом. Так, наприклад, катіони лужних металів мають конфігурацію інертних газів і не прагнуть до придбання електронів, так як мають низьку спорідненість до електрону. З цього можна зробити висновок, що, незважаючи на наявність у них незаповненою орбіталі, подібні частки не будуть електрофілами.
Взаємний вплив атомів в молекулах органічних сполук
Одним з найважливіших положень теорії будови органічних сполук О. М. Бутлерова є положення про те, що властивості атома в молекулі визначаються не тільки його природою, але і його найближчим оточенням.
До того як ми почнемо розглядати механізми реакцій органічних сполук, необхідно розглянути суть цього взаємного впливу атомів і груп атомів в органічних сполуках.
Індуктивний ефект. Розглянемо розподіл електронної щільності в молекулі Бромметан СН3 Вr. Зв'язок С-Вr в молекулі Бромметан полярна. Нагадаємо, що полярність зв'язку визначається електронегативні атомів хімічних елементів, т. Е. Їх здатність притягувати до себе електрони при утворенні хімічного зв'язку.
Електронегативність брому більше, ніж вуглецю, і в результаті цього на атомі брому утворюється частковий негативний заряд Þ-, а на атомі вуглецю - частковий позитивний заряд Þ +. Зсув електронів по зв'язку С-Вr можна показати двома способами - або вказавши частковий заряд на атомах, або стрілкою вздовж зв'язку.
СН Þ + -Вr Þ- СН3 -> Вr
Зсув електронної щільності о-зв'язку, що відбувається внаслідок відмінності електроотріцательностей даного атома і атома впливає групи, називається індуктивним ефектом (I).
Прийнято говорити, що атом з більшою електронегативність, що притягує до себе електрони, має негативний, акцепторні (to accept - приймати) ефектом, який позначається -I.
До чого ж може привести I-ефект брому?
Атом галогену в молекулі галогеналкани (бром в бромметане) легко заміщується на гідроксил-аніон під дією водного розчину лугу.
Гідроксил-аніон притягається до атому вуглецю (атакує атом вуглецю), на якому зосереджений частковий позитивний заряд, і заміщає бром, точніше, бромід-аніон.
У молекулі 1-хлорпропан електронна пара в зв'язку С-Сl зміщена в бік атома хлору внаслідок його більшої електронегативності. При цьому атом вуглецю, який отримав частковий позитивний заряд (§ +), відтягує електрони від пов'язаного з ним атома вуглецю. той, в свою чергу, від наступного:
Таким чином, індуктивний ефект передається по ланцюгу, але швидко згасає: він практично не спостерігається вже через три ст-зв'язку.
Розглянемо іншу реакцію - приєднання бромоводорода до етен:
СН2 = СН2 + НВr -> СН3-СН2Вr
На початковій стадії цієї реакції відбувається приєднання катіона водню до молекули, що містить кратну зв'язок:
СН2 = СН2 + Н + -> СН2-СН3
Електрони л-зв'язку змістилися до одного атома вуглецю, на сусідньому виявився позитивний заряд, незаповнена орбиталь.
Стійкість подібних частинок визначається тим, наскільки добре скомпенсований позитивний заряд на атомі вуглецю. Ця компенсація відбувається за рахунок зміщення електронної густини а-зв'язку в сторону позитивно зарядженого атома вуглецю, т. Е. Позитивного індуктивного ефекту (+1).
Група атомів, в даному випадку метильная група, від якої електронна щільність відтягується, володіє донорним ефектом, який позначається +1.
Мезомерний ефект. Існує інший спосіб впливу одних атомів або груп на інші - мезомерний ефект, або ефект сполучення.
Розглянемо молекулу бутадієну-1,3:
Виявляється, що подвійні зв'язки в цій молекулі - це не просто дві подвійні зв'язку! Так як вони знаходяться поруч, відбувається перекривання п -зв'язків, що входять до складу сусідніх подвійних, і утворюється загальне для всіх чотирьох атомів вуглецю п -Електронна хмара. При цьому система (молекула) стає більш стійкою. Це явище називається сполученням (в даному випадку п - п -сопряженіем).
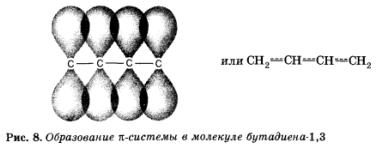
Додаткове перекривання, пару л-зв'язків, розділених однієї о-зв'язком, призводить до їх «усереднення». Центральна проста зв'язок набуває частковий «подвійний» характер, стає міцнішим і коротше, а подвійні - кілька слабшають і подовжуються.
Іншим прикладом сполучення може служити вплив подвійного зв'язку на атом, що має неподеленную електронну пару.
Так, наприклад, при дисоціації карбонової кислоти неподіленого електронних пара залишається на атомі кисню:
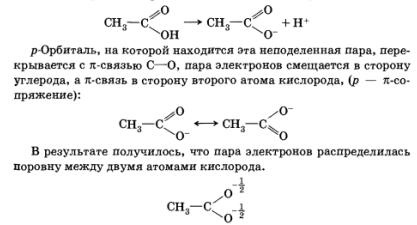
Це призводить до підвищення стійкості утворився при дисоціації аніона, збільшення сили кислоти.
Зсув електронної щільності в сполучених системах за участю п-зв'язків або неподіленого електронних пар називається мезомерним ефектом (М).
Основні механізми протікання реакцій
Ми виділили три основні типи реагують частинок - вільні радикали, електрофіли, нуклеофіли і три відповідних їм типу механізмів реакцій:
• вільнорадикальні;
• електрофільні;
• нуклеофіл'ние.
Крім класифікації реакцій по типу реагують частинок, в органічної хімії розрізняють чотири види реакцій за принципом зміни складу молекул: приєднання, заміщення, відщеплення, або елімінування (від англ. To eliminate - видаляти, отщеплять), і перегрупування. Оскільки приєднання і заміщення можуть відбуватися під дією всіх трьох типів реакціонноспо-собнимі частинок, можна виділити кілька основних механізмів протікання реакцій.
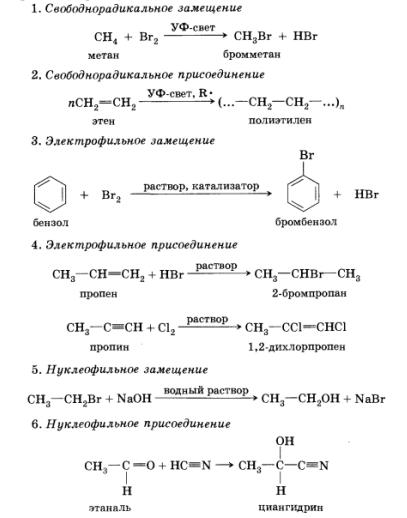
Крім цього, ми розглянемо реакції відщеплення, або елімінування, які йдуть під впливом нуклеофільних частинок - підстав.
Можна вважати, що в цій реакції відбувається відщеплення молекули бромоводорода від молекули 2-брометан. У присутності лугу утворюється бромід натрію і вода.
1. Що таке гомолитически і гетеролітичною розриви ковалентного зв'язку? Для яких механізмів утворення ковалентного зв'язку вони характерні?
2. Що називають електрофілами і нуклеофилами? Наведіть їх приклади.
3. У чому відмінності між мезомерним і індуктивним ефектами? Як ці явища ілюструють становище теорії будови органічних сполук О. М. Бутлерова про взаємний вплив атомів в молекулах органічних речовин?
4. У світлі уявлень про индуктивном і мезомерний ефект розгляньте взаємний вплив атомів в молекулах:
Підтвердіть свої висновки прикладами рівнянь хімічних реакцій.
Якщо у вас є виправлення або пропозиції до даного уроку, напишіть нам.
Якщо ви хочете побачити інші коригування та побажання до уроків, дивіться тут - Освітній форум.