Кислотно-основні властивості спиртів
у водному розчині кислотність спиртів внести такі зміни:
Формально, такий послідовності зміни кислотності спиртів можна було б очікувати на підставі збільшення індукційного ефекту радикалів в цьому ряду, що, в свою чергу, повинно приводити до збільшення електронної щільності на атомі кисню спирту. Вследстсвіе цього долж-но спостерігатися зменшення кислотності спиртів. Однак більш ймовірним є утворення менш міцної водневого зв'язку в цьому направ-лення, внаслідок збільшення просторових перешкод у міру збільшення обсягу вуглеводневої радикала в ряду:
Освіта водневого зв'язку завжди передує переносу протона в гідроксилвмісних розчинниках. У Таблиці 2 наведені дані про кислотність найпростіших спиртів, які підтверджують це положення.
кислотність спиртів
З цих даних випливає, що рівновага в системі спирт - луг завжди зміщена в бік спирту, а не алкоголята:
Для кількісного перетворення спирту в алкоголят потрібно використан-ня набагато більш сильних основ, таких як гідриди або аміди щелоч-них або лужноземельних металів або реактивів Гриньяра.
По відношенню до сильних мінеральних кислот спирти проявляють властивості основ і утворюють солі алкоксонія:
підставу кислота кислота 'підставу'
Ця реакція є першою стадією в реакціях спиртів, протікає в кислому середовищі, тобто при заміщенні гідроксильної групи на галоген, дегідратації спиртів і освіті простих ефірів.
Заміщення гідроксильної групи на галоген. отримання алкилгалогенидов
Відомо багато способів заміни гідроксильної групи спирту на галоген. Ці методи заміщення гідроксилу на галоген засновані на реакції спиртів з галогеноводородами, а також з галогенідами фосфору і оксогалогенідамі фосфору і сірки.
Отримання алкилгалогенидов зі спирту і галогеноводородних кислот
ROH + HHal → RHal + Н2 O
Реакційна здатність галогеноводородов зменшується в ряду HI> HBr> HC1 >> HF. Швидкість реакції заміщення зростає в ряду привчає-ний> вторинний> третинний спирт. Для отримання теоретичних алкілгало-генідов зазвичай досить обробити третинний спирт концентрований-ним водним розчином соляної, бромистоводневої або йодістоводород-ної кислоти при кімнатній температурі. Для отримання первинних і вторинних алкілбромідов і алкілйодідов зазвичай потрібно нагрівання суміші спирту з концент-рировать бромистоводневої або йодисто-водневої киць-лотой. Замість концентрованих водних розчинів НВr і HI можна використовувати броміди і йодиди натрію або калію і концентровану сірчану або фосфорну кислоту. Виходи алкилгалогенидов за цим методом зазвичай складають 75-90%. Окремі приклади наведені нижче.
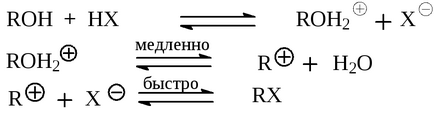
Першою стадією реакції є утворення зі спирту іона алкоксонія
Наступною стадією для первинних спиртів і деяких вторинних є SN 2 реакція заміщення води в катіоні алкоксонія на галоген:
для отримання алкілхлорідов при взаємодії первинних спиртів з соляною кислотою використовують електрофільні каталізатор - безводний хлорид цинку. Суміш соляної кислоти і хлориду цинку носить назву реактиву Лукаса. У відсутності каталізатора реакція протікає з набагато меншою швидкістю.
Третинні спирти і деякі вторинні взаємодіють з гало-геноводородом за механізмом SN l з утворенням в якості интермедиата карбокатіон, який далі з аніоном галогену образут кінцевий продукт.