У десятки разів слабкіше ковалентних зв'язків. Це не певні типи зв'язків, а неспецифічне взаємодія, яке виникає між різними хімічними угрупованнями, які мають високу спорідненість один до одного (спорідненість - це здатність до взаємодії). Наприклад: протилежно заряджені радикали.
Таким чином, слабкі типи зв'язків - це фізико-хімічні взаємодії. Тому вони дуже чутливі до змін умов середовища (температури, pH середовища, іонної сили розчину і так далі).
ВОДОРОДНАЯ ЗВ'ЯЗОК - це зв'язок, що виникає між двома електронегативними атомами за рахунок атома водню, який з'єднаний з одним з електронегативний атомів ковалентно (див. Малюнок).
Воднева зв'язок приблизно в 10 разів слабкіше, ніж ковалентний. Якщо водневі зв'язку повторюються багаторазово, то вони утримують поліпептидні ланцюжки з високою міцністю. Водневі зв'язки дуже чутливі до умов зовнішнього середовища і присутності в ній речовин, які самі здатні утворювати такі зв'язки (наприклад, сечовина).
Іонна зв'язок - виникає між позитивно і негативно зарядженими угрупованнями (додаткові карбонові та аміногрупи), які зустрічаються в радикалах лізину, аргініну, гістидину, аспарагінової і глутамінової кислот.
Гідрофобної взаємодії - неспецифічне тяжіння, що виникає в молекулі білка між радикалами гідрофобних амінокислот - викликається силами Ван-дер-Ваальса і доповнюється виштовхує силою води. Гідрофобна взаємодія слабшає або розривається в присутності різних органічних розчинників і деяких детергентів. Наприклад, деякі наслідки дії етилового спирту при проникненні його всередину організму обумовлені тим, що під його впливом послаблюються гідрофобні взаємодії в молекулах білків.
Просторова організація білкової молекули
В основі кожного білка лежить поліпептидний ланцюг. Вона не просто витягнута в просторі, а організована в тривимірну структуру. Тому існує поняття про 4-х рівнях просторової організації білка, а саме - первинної, вторинної, третинної і четвертинної структурах білкових молекул.
первинна структура
Первинна структура білка - послідовність амінокислотних залишків, міцно (і протягом всього періоду існування білка) з'єднаних пептидними зв'язками. Існує період напіввиведення білкових молекул - для більшості білків близько 2-х тижнів. Якщо стався розрив хоча б однієї пептидного зв'язку, то утворюється вже інший білок.
вторинна структура
Вторинна структура - це просторова організація стрижня поліпептидного ланцюга. Існують 3 найголовніших типу вторинної структури:
1) Альфа-спіраль - має певні характеристики: ширину, відстань між двома витками спіралі. Для білків характерна правозакрученная спіраль. У цій спіралі на 10 витків припадає 36 амінокислотних залишків. У всіх пептидів, покладених в таку спіраль, ця спіраль абсолютно однакова. Фіксується альфа-спіраль за допомогою водневих зв'язків між NH-групами одного витка спіралі і С = О групами сусіднього витка. Ці водневі зв'язку розташовані паралельно осі спіралі і багаторазово повторюються, тому міцно утримують спіралеподібну структуру. Більш того, утримують в кілька напруженому стані (як стислу пружину).
Б
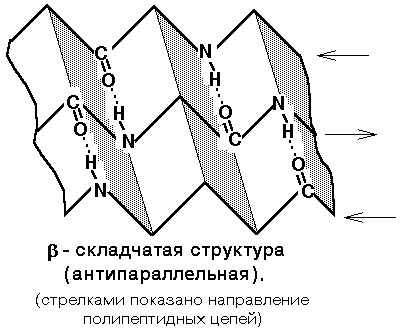
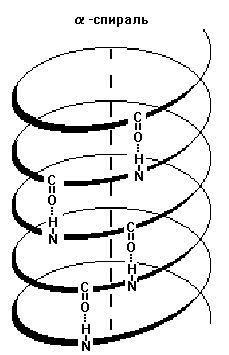
3) Нерегулярна структура - тип вторинної структури, в якому розташування різних ділянок поліпептидного ланцюга відносно один одного не має регулярного (постійного) характеру, тому нерегулярні структури можуть мати різну конформацію.